تعريف
الألومنيوميقع في الفترة الثالثة، المجموعة الثالثة من المجموعة الفرعية الرئيسية (أ) من الجدول الدوري. هذا هو العنصر الأول من الفترة الثالثة.
معدن. التعيين - آل. الرقم التسلسلي - 13. الكتلة الذرية النسبية - 26.981 وحدة دولية.
الهيكل الإلكتروني لذرة الألومنيوم
تتكون ذرة الألومنيوم من نواة موجبة الشحنة (+13)، يوجد بداخلها 13 بروتونًا و14 نيوترونًا. النواة محاطة بثلاثة أغلفة يتحرك من خلالها 13 إلكترونًا.
أرز. 1. رسم توضيحي تخطيطيهيكل ذرة الألومنيوم.
توزيع الإلكترونات بين المدارات هو كما يلي:
13 آل) 2) 8) 3 ;
1ق 2 2ق 2 2ص 6 3ق 2 3ص 1 .
في الخارج مستوى الطاقةيحتوي الألومنيوم على ثلاثة إلكترونات، جميعها إلكترونات المستوى الفرعي الثالث. يأخذ مخطط الطاقة الشكل التالي:
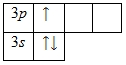
الحالة المثارة ممكنة نظريًا لذرة الألومنيوم بسبب وجود 3 شاغرة د-المدارات. ومع ذلك، الاقتران الإلكتروني 3 ق-المستوى الفرعي لا يحدث في الواقع.
أمثلة على حل المشكلات
مثال 1
3 أساسيات قم بتمييز العنصر عن طريق إدخال الكلمات المفقودة 1. الألومنيوم - العنصر المجموعة الثالثة، المجموعة الفرعية الرئيسية. 2. شحنة نواة ذرة الألومنيوم متساوية. يوجد 13 بروتونًا في نواة ذرة الألومنيوم. 4. يوجد 14 نيوترونًا في نواة ذرة الألومنيوم. 5. يوجد 13 إلكترونًا في ذرة الألومنيوم. 6. تحتوي ذرة الألومنيوم على 3 مستويات للطاقة. 7. غلاف الإلكترون له هيكل 2e، 8e، 3e. 8. على المستوى الخارجيهناك 3 إلكترونات في الذرة. 9. حالة أكسدة الذرة في المركبات تساوي المادة البسيطة الألومنيوم معدن. 11. أكسيد الألومنيوم وهيدروكسيد مذبذب في الطبيعة. التالي

4 البنية الإلكترونية للذرة 27 АlАl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 إدخال إلكتروني مختصر 1s21s2 2s22s2 2p 6 3s 2 3p 1 ملء الطلب الصفحة الرئيسية التالي



7 من تاريخ الاكتشاف الصفحة الرئيسية التالي أثناء اكتشاف الألومنيوم كان المعدن أغلى من الذهب. أراد البريطانيون تكريم الكيميائي الروسي العظيم دي.آي.مندلييف بهدية غنية؛ أصبح كوب الألمنيوم أغلى من كوب الذهب. إن "الفضة من الطين" الناتجة لم تكن مهتمة بالعلماء فحسب، بل أيضًا بالصناعيين وحتى إمبراطور فرنسا. التالي





12 1. معدن أبيض فضي 2. بريق معدني 3. أصلب المعدن 4. نقطة الانصهار +660 درجة مئوية 5. البلاستيك 6. سهل القطع بالسكين 7. يوصل التيار الكهربائي 8. خفيف الوزن 9. يوصل الحرارة 10. سهل ممغنط وغير ممغنط 11. Soft حدد واكتب أرقام تلك الخصائص التي تتعلق بالخصائص الفيزيائية للألمنيوم







الخصائص الفيزيائيةالألومنيوم معدن أبيض فضي. يذوب عند درجة حرارة 660 درجة مئوية. بلاستيك جدًا، يسهل سحبه إلى سلك ولفه في رقائق معدنية. لديها الموصلية الكهربائية والحرارية عالية جدا. يشكل سبائك خفيفة وقوية مع معادن أخرى



من تاريخ الاكتشاف أثناء اكتشاف الألومنيوم كان المعدن أغلى من الذهب. أراد البريطانيون تكريم الكيميائي الروسي العظيم دي.آي.مندلييف بهدية غنية؛ أصبح كوب الألمنيوم أغلى من كوب الذهب. إن "الفضة من الطين" الناتجة لم تكن مهتمة بالعلماء فحسب، بل أيضًا بالصناعيين وحتى إمبراطور فرنسا.


اختبر نفسك 1. كم عدد الإلكترونات الموجودة في ذرة الألومنيوم؟ أ) 1 ب) 6 ج) 13 د) 3 2. حالة أكسدة ذرة الألومنيوم في المركب Al 2 O 3 أ) -3 ب) -2 ج) +3 د)+2 3. هيدروكسيدات مذبذبة تشمل: أ) Mg (OH) 2 ب) Al(OH) 3 ج) H 2 Cr 2 O 7 د) Na OH 4. أكسدة الألومنيوم في وسط قلوي تنتج... أ) Al 3+ ب) Al 2 O 3 ج) - د) Al H 3 5. أكسيد الألومنيوم - ... أ) صلب أبيضب) غاز عديم اللون والرائحة ج) مادة صلبة حمراء د) سائل منخفض الغليان
 الاستنتاج: يتمتع الألومنيوم بخصائص مثل الخفة والقوة ومقاومة التآكل ومقاومة المواد الكيميائية القوية - وقد وجد الألومنيوم تطبيقًا واسعًا في الطيران والنقل الفضائي وفي العديد من الصناعات. الاقتصاد الوطني. يحتل الألمنيوم وسبائكه مكانة خاصة في الهندسة الكهربائية، وخلفها مستقبل علومنا وتقنيتنا.
الاستنتاج: يتمتع الألومنيوم بخصائص مثل الخفة والقوة ومقاومة التآكل ومقاومة المواد الكيميائية القوية - وقد وجد الألومنيوم تطبيقًا واسعًا في الطيران والنقل الفضائي وفي العديد من الصناعات. الاقتصاد الوطني. يحتل الألمنيوم وسبائكه مكانة خاصة في الهندسة الكهربائية، وخلفها مستقبل علومنا وتقنيتنا.

المؤسسة التعليمية لميزانية البلدية
مدرسة التعليم العام رقم 81
الألومنيوم. موقف الألومنيوم في الجدول الدوريوبنية ذرته. التواجد في الطبيعة. الخصائص الفيزيائية والكيميائية للألمنيوم.
مدرس كيمياء
مدرسة MBOU الثانوية رقم 81
2013
موضوع الدرس: الألومنيوم. موقع الألومنيوم في الجدول الدوري وتركيب ذرته. التواجد في الطبيعة. الخصائص الفيزيائية والكيميائية للألمنيوم.
أهداف الدرس:
النظر في توزيع الألومنيوم في الطبيعة، وخصائصه الفيزيائية والكيميائية، وكذلك خصائص المركبات التي يشكلها.
تقدم العمل
1. اللحظة التنظيميةدرس. 2. دراسة مواد جديدة. الألومنيومالمجموعة الفرعية الرئيسيةثالثا مجموعات الجدول الدوري هي البورون (B)، (Aل)، الغاليوم (Ga)، الإنديوم (In) والثاليوم (T l). وكما يتبين من البيانات المذكورة أعلاه، فقد تم اكتشاف كل هذه العناصر فيالقرن التاسع عشر.اكتشاف معادن المجموعة الفرعية الرئيسية
ثالثا
المجموعات

في
البورون هو مادة غير معدنية. الألومنيوم معدن انتقالي، في حين أن الغاليوم والإنديوم والثاليوم معادن كاملة. وهكذا، مع زيادة نصف قطر ذرات عناصر كل مجموعة من الجدول الدوري، تزداد الخواص المعدنية للمواد البسيطة.في هذه المحاضرة سوف نلقي نظرة فاحصة على خصائص الألومنيوم.1. موقع الألمنيوم في طاولة D. I. Mendeleev. التركيب الذري، حالات الأكسدة المعروضة. يقع عنصر الألومنيوم فيثالثا المجموعة، المجموعة الفرعية الرئيسية "أ"، الفترة الثالثة من النظام الدوري، الرقم التسلسلي رقم 13، الكتلة الذرية النسبيةع (آل ) = 27. جاره على اليسار في الجدول هو المغنيسيوم، وهو معدن نموذجي، وعلى اليمين السيليكون، وهو مادة غير معدنية. وبالتالي، يجب أن يظهر الألومنيوم خصائص ذات طبيعة وسيطة وتكون مركباته مذبذبة.آل +13) 2 ) 8 ) 3 , ف – عنصر,
الحالة الأرضية
1 ق 2 2 ق 2 2 ص 6 3 ق 2 3 ص 1
يُظهر الألومنيوم حالة أكسدة +3 في المركبات:آل 0 - 3 ه - → آل +3 2. الخصائص الفيزيائية الألومنيوم في شكله الحر هو معدن أبيض فضي ذو موصلية حرارية وكهربائية عالية. نقطة الانصهار 650يا ج- الألومنيوم ذو كثافة منخفضة (2.7 جم/سم3). 3 ) - أقل بثلاث مرات تقريبًا من الحديد أو النحاس، وفي نفس الوقت فهو معدن متين.3. التواجد في الطبيعة من حيث الانتشار في الطبيعة، فإنه يحتل المرتبةالأول بين المعادن والثالث بين العناصر ، في المرتبة الثانية بعد الأكسجين والسيليكون. وتتراوح نسبة محتوى الألومنيوم في القشرة الأرضية، بحسب الباحثين المختلفين، من 7.45 إلى 8.14% من كتلة القشرة الأرضية.في الطبيعة، يوجد الألومنيوم فقط في المركبات (المعادن). بعض منهم: البوكسيت - Al 2 O 3 H 2 O (مع شوائب SiO 2، Fe 2 O 3، CaCO 3) النيفيلين - KNa 3 4 الألونيت - KAl (SO 4) 2 2Al (OH) 3 الألومينا (خليط من الكاولين مع الرمل SiO 2، الحجر الجيري CaCO 3، المغنسيت MgCO 3) اكسيد الالمونيوم - Al 2 O 3 الفلسبار (أورثوكلاز) - ك 2 O×Al 2 O 3 ×6SiO 2 الكاولينيت - Al 2 O 3 ×2SiO 2 × 2H 2 O الألونيت - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3 البريل - 3BeO Al 2 O 3 6SiO 2البوكسيت
4. الخصائص الكيميائيةالألومنيوم ومركباته يتفاعل الألومنيوم بسهولة مع الأكسجين عندما الظروف العاديةومغطاة بفيلم أكسيد (يعطي مظهرًا غير لامع).يبلغ سمكها 0.00001 ملم، ولكن بفضلها لا يتآكل الألمنيوم. لدراسة الخواص الكيميائية للألمنيوم، تتم إزالة طبقة الأكسيد. (استخدام ورق زجاجأو كيميائياً: أولاً عن طريق الغمس في محلول قلوي لإزالة طبقة الأكسيد، ثم في محلول أملاح الزئبق لتكوين سبيكة من الألومنيوم مع الزئبق - ملغم).أنا . التفاعل مع المواد البسيطة الألومنيوم بالفعل درجة حرارة الغرفةيتفاعل بنشاط مع جميع الهالوجينات مكونا الهاليدات. عند تسخينه، يتفاعل مع الكبريت (200 درجة مئوية)، والنيتروجين (800 درجة مئوية)، والفوسفور (500 درجة مئوية)، والكربون (2000 درجة مئوية)، مع اليود في وجود محفز - الماء: 2أ ل + 3 ق = أ ل 2 ق 3 (كبريتيد الألومنيوم)، 2A l + N 2 = 2A lN (نيتريد الألومنيوم)،أ ل + ف = أ ل ف (فوسفيد الألومنيوم)، 4أ ل + 3ج = أ ل 4 ج 3 (كربيد الألومنيوم). 2 آل + 3 ط 2 = 2 أ ل 3 (يوديد الألومنيوم)يتم تحلل جميع هذه المركبات بالكامل لتكوين هيدروكسيد الألومنيوم، وبالتالي كبريتيد الهيدروجين والأمونيا والفوسفين والميثان: آل 2 س 3 + 6 ساعات 2 O = 2Al(OH) 3 + 3 ساعات 2 سآل 4 ج 3 +12 ساعة 2 O = 4Al(OH) 3 +3CH 4 على شكل رقائق أو مسحوق، فإنه يحترق بشكل مشرق في الهواء، ويطلق عدد كبيرحرارة: 4A l + 3 O 2 = 2A l 2 O 3 + 1676 كيلوجول.
ثانيا. التفاعل مع المواد المعقدة التفاعل مع الماء : 2 Al + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 بدون فيلم أكسيد التفاعل مع أكاسيد المعادن: يعتبر الألومنيوم عامل اختزال جيد، لأنه أحد المعادن النشطة. ويصنف في سلسلة النشاط مباشرة بعد الفلزات القلوية الترابية. لهذا السببيستعيد المعادن من أكاسيدها . يُستخدم هذا التفاعل، المعروف باسم الألومنيوم الحراري، لإنتاج معادن نادرة نقية، مثل التنغستن والفاناديوم وما إلى ذلك. 3 Fe 3 O 4 + 8 Al = 4 Al 2 O 3 + 9 Fe + Q خليط الثرمايت Fe 3 يا 4 و آل (مسحوق) – يستخدم أيضا في لحام الثرمايت. C r 2 O 3 + 2A l = 2C r + A l 2 O 3 التفاعل مع الأحماض : بمحلول حامض الكبريتيك: 2Al + 3H 2 SO 4 = آل 2 (SO 4 ) 3 + 3 ح 2 لا يتفاعل مع الكبريت المركز البارد والنيتروجين (المخمول). ولذلك، يتم نقل حمض النيتريك في خزانات الألومنيوم. عند تسخينه، يكون الألومنيوم قادرًا على تقليل هذه الأحماض دون إطلاق الهيدروجين: 2A l + 6H 2 SO 4 (conc) = Al 2 (SO 4 ) 3 + 3 SO 2 + 6H 2 O, Al + 6H NO 3 (conc) = Al (NO 3 ) 3 + 3 NO 2 + 3ح2س. التفاعل مع القلويات . 2 Al + 2 NaOH + 6 H 2 O = 2 Na Al(OH) 4 + 3 H 2 نا[أ ل(هو) 4 ] – رباعي هيدروكسي ألومينات الصوديوم بناءً على اقتراح الكيميائي جوربوف، خلال الحرب الروسية اليابانية، تم استخدام هذا التفاعل لإنتاج الهيدروجين للبالونات. مع المحاليل الملحية: 2 Al + 3 CuSO 4 = Al 2 (SO 4 ) 3 + 3 Cu إذا تم فرك سطح الألومنيوم بملح الزئبق يحدث التفاعل التالي: 2 آل + 3 زئبق الكلور 2 = 2 AlCl 3 + 3 زئبقيذيب الزئبق المنطلق الألومنيوم، ويشكل ملغمًا. 5. تطبيق الألمنيوم ومركباته

تحدد الخصائص الفيزيائية والكيميائية للألمنيوم خصائصه تطبيق واسعفي التكنولوجيا.صناعة الطيران هي المستهلك الرئيسي للألمنيوم : ثلثي الطائرة يتكون من الألمنيوم وسبائكه. ستكون الطائرة الفولاذية ثقيلة جدًا ويمكن أن تحمل عددًا أقل بكثير من الركاب.ولهذا السبب يسمى الألومنيوم بالمعدن المجنح. الكابلات والأسلاك مصنوعة من الألومنيوم : مع نفس الموصلية الكهربائية، كتلتها أقل مرتين من منتجات النحاس المقابلة.وبالنظر إلى مقاومة التآكل للألمنيوم، فهو كذلكتصنيع أجزاء من الأجهزة والحاويات ل حمض النيتريك . يعتبر مسحوق الألمنيوم هو الأساس لصناعة طلاء الفضة لحماية منتجات الحديد من التآكل، ولعكس الأشعة الحرارية، ويستخدم هذا الطلاء لتغطية صهاريج تخزين النفط وبدلات رجال الإطفاء.يستخدم أكسيد الألومنيوم لإنتاج الألومنيوم وأيضا كمادة حرارية.هيدروكسيد الألومنيوم هو المكون الرئيسي للأدوية المعروفة مالوكس والماجيل التي تقلل من حموضة عصير المعدة. يتم تحلل أملاح الألومنيوم بدرجة عالية. هذه الخاصيةيستخدم في عملية تنقية المياه. كبريتات الألومنيوم و كمية صغيرةالجير المطفأ لتحييد الحمض الناتج. ونتيجة لذلك، يتم إطلاق راسب ضخم من هيدروكسيد الألومنيوم، والذي يحمل في طياته جزيئات معلقة من التعكر والبكتيريا.وبالتالي، كبريتات الألومنيوم هو مادة تخثر.6. إنتاج الألمنيوم 1) تم اختراع طريقة حديثة وفعالة من حيث التكلفة لإنتاج الألومنيوم من قبل القاعة الأمريكية والفرنسي هيرولت في عام 1886. أنها تنطوي على التحليل الكهربائي لمحلول أكسيد الألومنيوم في الكريوليت المنصهر. الكريوليت المنصهر Na 3 AlF 6 يذيب Al 2 O 3، كيف يذوب الماء السكر . يحدث التحليل الكهربائي "لمحلول" أكسيد الألومنيوم في الكريوليت المنصهر كما لو كان الكريوليت هو المذيب فقط وأكسيد الألومنيوم هو المنحل بالكهرباء. 2Al 2 O 3 التيار الكهربائي → 4Al + 3O 2 في "موسوعة الأولاد والبنات" الإنجليزية تبدأ المقالة عن الألمنيوم في الكلمات التالية: "في 23 فبراير 1886، بدأ عصر معدني جديد في تاريخ الحضارة - عصر الألمنيوم. في مثل هذا اليوم، دخل تشارلز هول، وهو كيميائي يبلغ من العمر 22 عامًا، إلى مختبر معلمه الأول وفي يده عشرات الكرات الصغيرة من الألومنيوم الأبيض الفضي ومعه أخبار تفيد بأنه وجد طريقة لصنع المعدن بسعر رخيص وبتكلفة منخفضة. بكميات كبيرة." وهكذا أصبح هول مؤسس أمريكان صناعة الألمنيوموبطل قومي أنجلوسكسوني، كرجل صنع عملاً عظيمًا من العلم. 2) 2Al 2 O 3 + 3 C = 4 Al + 3 CO 2 هذا مثير للاهتمام:
- تم عزل معدن الألمنيوم لأول مرة في عام 1825 من قبل الفيزيائي الدنماركي هانز كريستيان أورستد. ومن خلال تمرير غاز الكلور عبر طبقة من أكسيد الألومنيوم الساخن الممزوج بالفحم، عزل أورستد كلوريد الألومنيوم دون أدنى أثر للرطوبة. لاستعادة الألومنيوم المعدني، احتاج أورستد إلى معالجة كلوريد الألومنيوم بملغم البوتاسيوم. وبعد عامين، الكيميائي الألماني فريدريش فولر. وقام بتحسين الطريقة عن طريق استبدال ملغم البوتاسيوم بالبوتاسيوم النقي.
في القرنين الثامن عشر والتاسع عشر، كان الألومنيوم هو العنصر الرئيسي مجوهرات معدنية. في عام 1889، تم منح D.I Mendeleev في لندن لخدماته في تطوير الكيمياء هدية قيمة- موازين مصنوعة من الذهب والألومنيوم.
بحلول عام 1855، كان العالم الفرنسي سان كلير ديفيل قد طور طريقة لإنتاج معدن الألمنيوم على نطاق تقني. لكن الطريقة كانت مكلفة للغاية. تمتع ديفيل برعاية خاصة من نابليون الثالث، إمبراطور فرنسا. وكدليل على إخلاصه وامتنانه، صنع ديفيل لابن نابليون، الأمير المولود، خشخيشة منقوشة بأناقة - أول "منتج استهلاكي" مصنوع من الألومنيوم. حتى أن نابليون كان ينوي تجهيز حراسه بدرع من الألومنيوم، لكن تبين أن السعر باهظ. في ذلك الوقت، كان 1 كجم من الألومنيوم يكلف 1000 مارك، أي. 5 مرات أغلى من الفضة. فقط بعد اختراع عملية التحليل الكهربائي، أصبح الألومنيوم مساويًا في القيمة للمعادن العادية.
هل تعلم أن الألمنيوم عند دخوله إلى جسم الإنسان يسبب اضطراباً؟ الجهاز العصبي. عندما يكون في الزائدة، يتم تعطيل عملية التمثيل الغذائي. أ معدات الحمايةهو فيتامين C، ومركبات الكالسيوم، والزنك.
عندما يحترق الألومنيوم في الأكسجين والفلور، يتم إطلاق الكثير من الحرارة. ولذلك، يتم استخدامه كمادة مضافة لوقود الصواريخ. يحرق صاروخ ساتورن 36 طنًا من مسحوق الألومنيوم أثناء طيرانه. تم اقتراح فكرة استخدام المعادن كمكون لوقود الصواريخ لأول مرة بواسطة F. A. Zander.
يفكر! لماذا لا يمكن تنفيذ هذا التفاعل في محلول مائي؟ №2. أكمل معادلات التفاعلات الكيميائية:
آل + ح 2 SO 4 (الحل) ->
آل + CuCl 2 ->
آل + HNO 3 (conc) - t ->
آل + هيدروكسيد الصوديوم + H2O -> لا. 3. حل المشكلة:
تم تعريض سبيكة من الألومنيوم والنحاس لكمية زائدة من محلول هيدروكسيد الصوديوم المركز أثناء التسخين. تم إطلاق 2.24 لتر من الغاز (رقم). احسب النسبة المئوية لتكوين السبيكة إذا كانت كذلك الكتلة الإجماليةهل كان 10 جرام؟4. العمل في المنزل ملحوظة: يمكن استخدام العرض التقديمي في الفصل"الألومنيوم. موقع الألومنيوم في الجدول الدوري وتركيب ذرته. التواجد في الطبيعة. الخواص الفيزيائية والكيميائية للألمنيوم."
أهداف الدرس:
تعليمية –دراسة الخواص الفيزيائية والكيميائية للألمنيوم ومجالات تطبيقه. عرض الخصائص عنصر كيميائيالألومنيوم ودراسة بنية الذرة.
التنموية –تطوير مهارات إجراء التجارب، ونقل محتوى النصوص العلمية والتعليمية إلى شكل رسوم بيانية؛ تطوير مهارات الاتصالمهارات الاستماع والقدرة على التعبير عن أفكارك بشكل صحيح.
تعليمية –تنمية ثقافة العمل مع المواد الكيميائية، والامتثال للوائح السلامة، وتنمية الانضباط الواعي والوضوح والتنظيم في العمل.
يجب أن يعرف الطلاب:
هيكل ذرة الألومنيوم، الخواص الفيزيائية والكيميائية للألمنيوم كمادة بسيطة، مجالات التطبيق.
يجب أن يكون الطلاب قادرين على:
يميز الألومنيوم، وهو عنصر كيميائي ومادة بسيطة. اكتب معادلات التفاعل التي تثبت الخواص الكيميائية للألمنيوم في صورته الجزيئية والأكسدة.
نوع الدرس:
تعلم مواد جديدة.
شكل التنظيم الأنشطة التعليميةطلاب:
العمل الجماعي، العمل الفردي، التجربة الكيميائية.
طرق وتقنيات التدريس:
استكشافية، بحث جزئي، تجربة كيميائية توضيحية، العمل في مجموعات، إجابات شفهية على السبورة، عمل مستقلمع النصوص، والسيطرة المتبادلة.
معدات الدرس:
نصوص علمية وتعليمية حول موضوع الدرس، بطاقات مهام حول الأسئلة الفردية للخطة الدراسية للمادة لكل مجموعة، PSHE،
مجموعة "الألومنيوم ومركباته"، رقائق الألومنيوم، حمض الهيدروكلوريك وهيدروكسيد الصوديوم، الألومنيوم، معدات المختبرات.
1. اللحظة التنظيمية.
المعلم يحيي الطلاب .
2. تحديث المعرفة الأساسية وتوصيل موضوع الدرس وأهدافه وبنيته:
الكلمة الافتتاحية للمعلم
بمفردك وبالعمل ستفعل كل شيء
سواء لأحبائك أو لنفسك ،
وإذا لم يكن هناك نجاح في العمل،
الفشل ليس مشكلة، حاول مرة أخرى.
دي آي مندليف.
نواصل دراسة كبيرة و موضوع مهم"المعادن". سنتعرف اليوم في الدرس على المعدن الذي تعرفه جيدًا منذ الطفولة. أريد أن أبدأ هذا الدرس بأسطورة.
"في أحد الأيام، جاء شخص غريب إلى الإمبراطور الروماني تيبيريوس. وكهدية للإمبراطور، أحضر وعاءً صنعه من معدن لامع كالفضة، ولكنه خفيف للغاية. قال السيد إنه حصل على هذا المعدن من "الأرض الطينية". لكن الإمبراطور، خوفًا من انخفاض قيمة ذهبه وفضته، أمر بقطع رأس السيد وتدمير ورشته. ما المعدن الذي نتحدث عنه؟
(حول الألومنيوم)
مدرس:
وهكذا يكون موضوع درسنا: "الألومنيوم عنصر كيميائي ومادة بسيطة".
يتم صياغة أهداف الدرس.
خطة دراسة الموضوع في مجموعات:
- الخصائص الفيزيائية للألمنيوم.
- الخواص الكيميائية للألمنيوم.
- استخدامات الألمنيوم ووجوده في الطبيعة.
خطة العمل الجماعي:
ادرس النص وأبرز المعلومات ذات الصلة بسؤالك؛
- استكمال المهام المقترحة؛
- قم بإعداد خطاب حول قضيتك، يعتمد على الإيجاز والوضوح ووضوح العرض
العمل الجماعي لدراسة المادة.
قم بإعداد خطاب حول مشكلتك.
المجموعة 1.
خصائص عنصر الألومنيوم الكيميائي حسب موقعه في PSHE.
يمارس:
- اقرأ النص.
- توصيف الألمنيوم حسب موقعه في PSHE حسب المخطط:
أ) الرقم التسلسلي.
ب) الكتلة الذرية.
ب) الفترة (الصغيرة والكبيرة).
د) المجموعة (المجموعة الفرعية: الرئيسية أو الثانوية).
د) علامة كيميائية.
هـ) تركيب الذرة (الشحنة النووية، عدد البروتونات، الإلكترونات، النيوترونات، الصيغة الإلكترونية).
ط) الأكاسيد.
ك) مركبات الهيدروجين المتطايرة.
2. ناقش النتائج التي تم الحصول عليها في المجموعة وأجب عن الأسئلة:
- ما عدد الإلكترونات الموجودة في المستوى الخارجي لذرة الألومنيوم؟
- هل سيعطي الألومنيوم هذه الإلكترونات أم سيقبلها؟
- ما حالة الأكسدة التي سيكتسبها أيون الألومنيوم في هذه الحالة؟
- استنتج: ما هي فئة المركبات التي ينتمي إليها الألومنيوم (معدنية أو غير معدنية)
- قارن نشاط العنصر الكيميائي الألومنيوم مع عناصر المجموعتين 1 و 2 لنفس الفترة.
- إعداد خطاب وفقا ل هذه القضية، قائم على على الإيجاز والوضوح ووضوح العرض.
المجموعة 2.
الخصائص الفيزيائية للألمنيوم.
يمارس:
- اقرأ النص.
- قم بتسليط الضوء على المواد ذات الصلة بسؤالك.
- النظر في مجموعة "الألومنيوم وسبائكه".
- ناقش الأسئلة التالية في مجموعتك:
- أ) الحالة الفيزيائية، اللون، اللمعان، الكثافة (خفيفة أو ثقيلة)، الانصهار (سهلة أو حرارية)، التوصيل الكهربائي والحراري، البلاستيك.
- ب) عرض البيانات التي تم الحصول عليها في شكل رسم بياني.
5. إعداد خطاب للسؤال المطروح بناءً على على الإيجاز ووضوح العرض.
المجموعة 3.
الخواص الكيميائية للألمنيوم.
يمارس:
- اقرأ النص.
- قم بتسليط الضوء على المواد ذات الصلة بسؤالك.
- دراسة سلوك الألمنيوم بالنسبة للمواد المعقدة؟
- ينفذ العمل المختبريباستخدام التعليمات
يمارس:
أ) إجراء التجارب.
ب) مناقشة الظواهر المرصودة في المجموعة.
ج) اكتب معادلة التفاعل.
د) استخلاص النتائج.
5. إعداد خطاب حول هذه القضية، على أساس الإيجاز والوضوح ووضوح العرض.
المجموعة 4.
تطبيق الألومنيوم.
يمارس:
- اقرأ النص.
- قم بتسليط الضوء على المواد ذات الصلة بسؤالك.
- ناقش في المجموعة الأسئلة التالية:
أ) ما هو دور الألمنيوم في حياة الإنسان؟
ب) استخدام الألمنيوم كمادة بسيطة.
- ارسم مخططًا يوضح استخدامات الألومنيوم.
- إعداد خطاب حول هذه القضية، على أساس الإيجاز والوضوح ووضوح العرض
- تقرير جماعي عن القضايا المدروسة.
تقدم كل مجموعة، بعد أن أكملت جميع المهام، عرضًا تخطيطيًا لسؤالها مع المناقشة والتعليقات، ويقوم الطلاب بتدوين الملاحظات، ونقل المخططات المقترحة إلى دفاتر الملاحظات، ونتيجة لجميع المجموعات، يتم تقديم مخطط داعم حول موضوع الدرس وضعت خطوة بخطوة.
استنتاجات حول موضوع الدرس:
ما عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لذرة الألومنيوم؟
- ما هي حالة الأكسدة التي تمتلكها ذرة الألومنيوم؟ لماذا؟ ماذا عن ايون؟
- ما هي التجارب التي أثبتنا بها أن الألومنيوم معدن نشط؟
- ما هي المواد التي تسمى مذبذبة؟
- ما هي الخصائص التي تعتمد عليها التطبيقات التالية؟
- أين يوجد في الجسم أكبر قدر من الألومنيوم؟
- هل من الممكن منذ وقت طويلتخزين المواد الغذائية في حاويات الألومنيوم؟
- العمل في المنزل:§ 13 إلى الصفحة 60، ؟ 1، 4. إعداد عرض تقديمي عن استخدام الألمنيوم.
- الكلمات الأخيرة من المعلم.
يشكر المعلم الطلاب على تعاونهم ويقيم المتحدثين على السبورة.
مرجع.
الألومنيوم.
تشمل المجموعة الفرعية الرئيسية للمجموعة الثالثة العناصر: البورون والألومنيوم والجاليوم والإنديوم والثاليوم. وفي الطبقة الإلكترونية الخارجية تحتوي ذرات هذه العناصر على ثلاثة إلكترونات (…ns2np1). وهي عناصر p. وفي التفاعلات تكون ذرات هذه العناصر بمثابة عوامل اختزال، باستثناء البورون غير المعدني الذي يمكن أن يكون عاملاً مؤكسدًا. جميع عناصر هذه المجموعة الفرعية معرضة أعلى درجةالأكسدة +3. أنها تشكل أكاسيد أعلى E2O3 وهيدروكسيدات E(OH)3، والتي تظهر خصائص مذبذبة. الألومنيوم هو الأكثر أهمية في هذه المجموعة الفرعية.
الألومنيوم في شكله الحر هو معدن أبيض فضي، وله لمعان، وموصلية حرارية وكهربائية عالية (أقل من النحاس في هذا الصدد)، وخفيف الوزن (كثافة 2.7 جم / سم 3) وفي نفس الوقت معدن متين. وهو معدن ناعم ومرن، يمكن لفه إلى رقائق أو سحبه إلى سلك. يذوب عند درجة حرارة 6600 درجة مئوية. عند درجة حرارة 6000 درجة مئوية، يصبح الألومنيوم هشًا ويمكن سحقه إلى حبيبات أو مسحوق.
الألومنيوم هو معدن يتم تغطية سطحه عادة بطبقة رقيقة ومتينة من الأكسيد. على شكل نشارة ومسحوق، فإنه يحترق بشكل مشرق في الهواء، ويطلق كمية كبيرة من الحرارة.
في درجة حرارة الغرفة يتفاعل بنشاط مع الهالوجينات، عند تسخينه، يتفاعل مع الكبريت (2000 درجة مئوية)، والنيتروجين (8000 درجة مئوية) وغيرها من المعادن غير المعدنية.
نسبة الألمنيوم إلى المواد المعقدة:
يذوب الألومنيوم في حمض الهيدروكلوريكأي تركيز:
يذوب الألومنيوم في المحاليل القلوية:
يلعب الألمنيوم دورًا مهمًا الدور البيولوجيفي حياة الشخص. يشارك في بناء الأنسجة الظهارية والضامة. محتوى الألومنيوم في جسم الإنسان (لكل 70 كجم من وزن الجسم) هو 61 مجم. يوجد في جميع الأعضاء والأنسجة: والأهم من ذلك كله في الكبد والرئتين والعظام والدماغ. إن المدخول الرئيسي للألمنيوم في الجسم هو الطعام - وهو المخبوزات والشاي (من 20 إلى 200 مجم لكل 100 جرام من المنتج) والبطاطس - 4 مجم لكل 100 جرام. المنتج اللفت الأصفر – 46 ملغ لكل 100 غرام من المنتج.
عند طهي الطعام وتخزينه في أواني الطبخ المصنوعة من الألومنيوم، يتضاعف محتوى الألومنيوم الموجود في الطعام. تؤدي زيادة محتوى الألومنيوم في الدم إلى تحفيز الجهاز العصبي المركزي. مع وجود فائض من الألومنيوم في الجسم النشاط الحركي، النوبات، فقدان الذاكرة، أمراض الكبد والكلى. عندما ينخفض محتوى الألومنيوم، يتم تثبيط الجهاز العصبي المركزي.
مجالات تطبيق الألومنيوم عديدة جدا. بسبب خفة وزنها وقوتها، يُستخدم الألمنيوم وسبائكه في صناعة الطائرات والصواريخ (يُطلق على الألومنيوم اسم المعدن المجنح)، وفي بناء السفن والسيارات؛ في البناء - للتصنيع إطارات النوافذوالأبواب، وتستخدم خفة الألمنيوم وحسن توصيله الكهربائي في صناعة الأسلاك الكهربائية لخطوط الكهرباء. تعد الموصلية الحرارية وعدم السمية أمرًا مهمًا في صناعة تجهيزات المطابخ المصنوعة من الألومنيوم ورقائق الألومنيوم لتخزين الطعام. مسحوق الألمنيوم هو الأساس لإنتاج طلاء الفضة لحماية منتجات الحديد من التآكل. تُستخدم قدرة الألومنيوم على الاحتراق في الهواء بلهب ساطع في تحضير الألعاب النارية الملونة وصناعة الماسات.