Temat: Właściwości chemiczne pierwiastków.
Plan:
1. Właściwości metali i ich związków ( Rozdziały I i II podgr.)
1.1 Elementy IA
1.2 Elementy IIA ogólna charakterystyka grup.
2. Właściwości chemiczne pierwiastków.
2.1 Elementy IIIA ogólna charakterystyka grup.
2.2 Elementy IVA ogólna charakterystyka grup.
Elementy 2,3 VA ogólna charakterystyka grup.
2.4 Elementy VIA ogólna charakterystyka grup.
2.5 Elementy VIIA ogólna charakterystyka grup.
2.6 Elementy VIIIA ogólna charakterystyka grup.
3. Wodór
Metale alkaliczne pierwiastki głównej podgrupy I grupy I układu okresowego pierwiastków chemicznych D. I. Mendelejewa: lit Li, sód Na, potas K, rubid Rb, cez Cs i frans Fr. Metale te nazywane są metalami alkalicznymi, ponieważ większość ich związków jest rozpuszczalna w wodzie. W języku słowiańskim „ługowanie” oznacza „rozpuścić”, co zadecydowało o nazwie tej grupy metali. Kiedy metale alkaliczne rozpuszczają się w wodzie, tworzą się rozpuszczalne wodorotlenki zwane zasadami. G. Davy jako pierwszy uzyskał wolny potas i sód w 1807 roku.
W zewnętrznej warstwie elektronowej atomy metali alkalicznych mają po jednym elektronie. W drugiej zewnętrznej warstwie elektronowej atom litu zawiera dwa elektrony, a atomy pozostałych metali alkalicznych mają po osiem elektronów. Mając tylko jeden elektron w zewnętrznej warstwie elektronowej, znajdującej się w stosunkowo dużej odległości od jądra, atomy tych pierwiastków dość łatwo oddają ten elektron, czyli charakteryzują się niską energią jonizacji. Powstałe w tym przypadku pojedynczo naładowane jony dodatnie mają stabilną strukturę elektronową odpowiedniego gazu szlachetnego (struktura jonów litu atomu helu, atom neonu jonu sodu itp.). Łatwość oddawania elektronów zewnętrznych charakteryzuje rozważane pierwiastki jako najbardziej typowych przedstawicieli metali: właściwości metaliczne są szczególnie widoczne w metalach alkalicznych.
Identyczna budowa nie tylko zewnętrznej, ale i przedostatniej warstwy elektronowej atomów wszystkich metali alkalicznych, z wyjątkiem litu, decyduje o dużym podobieństwie właściwości tych pierwiastków. Jednocześnie wzrost ładunku jądrowego i całkowitej liczby elektronów w atomie podczas przemieszczania się od góry do dołu przez podgrupę powoduje pewne różnice w ich właściwościach. Podobnie jak w innych grupach różnice te objawiają się głównie wzrostem łatwości oddawania elektronów walencyjnych oraz wzrostem właściwości metalicznych wraz ze wzrostem liczby atomowej.
|
Właściwości metali alkalicznych |
||||||||
|
Atomowy |
Nazwa, |
Metal |
joński |
Potencjał |
EO |
P, |
TPL, |
kip, |
|
Lit Li |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
Na sodu |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
Potas K |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
Rubid Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
Cez C |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
Właściwości chemiczne metali alkalicznych. Ze względu na dużą aktywność chemiczną metali alkalicznych w stosunku do wody, tlenu i azotu, są one magazynowane pod warstwą nafty. Aby przeprowadzić reakcję z metalem alkalicznym, kawałek odpowiedni rozmiar ostrożnie odcina się skalpelem pod warstwą nafty, w atmosferze argonu powierzchnię metalu dokładnie oczyszcza się z produktów jego interakcji z powietrzem i dopiero wtedy próbkę umieszcza się w naczyniu reakcyjnym.
1. Interakcja z wodą. Ważna właściwość metali alkalicznychich wysoka aktywność w odniesieniu do wody. Lit najspokojniej (bez wybuchu) reaguje z wodą:
Kiedy przeprowadza się podobną reakcję, sód pali się żółtym płomieniem i następuje niewielka eksplozja. Potas jest jeszcze bardziej aktywny: w tym przypadku eksplozja jest znacznie silniejsza, a płomień jest kolorowy fioletowy. 2. Interakcja z tlenem. Produkty spalania metali alkalicznych w powietrzu mają inny skład w zależności od aktywności metalu.
Tylko lit spala się w powietrzu, tworząc tlenek o składzie stechiometrycznym:
Podczas spalania sodu nadtlenek Na2O2 powstaje głównie z niewielką domieszką nadtlenku NaO2:
Produkty spalania potasu, rubidu i cezu zawierają głównie ponadtlenki: ![]()
Aby otrzymać tlenki sodu i potasu, mieszaniny wodorotlenku, nadtlenku lub ponadtlenku z nadmiarem metalu ogrzewa się bez dostępu tlenu: 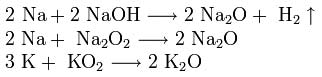
Dla związków tlenowych metali alkalicznych charakterystyczny jest następujący wzór: wraz ze wzrostem promienia kationu metalu alkalicznego wzrasta stabilność związków tlenowych zawierających jon nadtlenkowy O22 i jon ponadtlenkowy O2-.
Ciężkie metale alkaliczne charakteryzują się tworzeniem dość stabilnych ozonków o składzie EO3. Wszystkie związki tlenu mają różne barwy, których intensywność pogłębia się w szeregu od Li do Cs:
|
Formuła |
Kolor |
|
Li2O |
Biały |
|
Na2O |
Biały |
|
K2O |
Żółtawy |
|
Rb2O |
Żółty |
|
CS2O |
Pomarańczowy |
|
Na2O2 |
Światło |
|
KO 2 |
Pomarańczowy |
|
RbO2 |
Ciemny- |
|
CSO2 |
Żółty |
Tlenki metali alkalicznych mają wszystkie właściwości tlenków zasadowych: reagują z wodą, tlenkami kwasowymi i kwasami: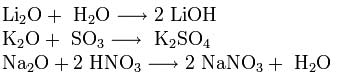
Nadtlenki i ponadtlenki wykazują właściwości silnych utleniaczy:
Nadtlenki i ponadtlenki intensywnie oddziałują z wodą tworząc wodorotlenki:
3. Interakcja z innymi substancjami. Metale alkaliczne reagują z wieloma niemetalami. Po podgrzaniu łączą się z wodorem, tworząc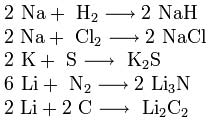 wodorki, z halogenkami, siarką, azotem, fosforem, węglem i krzemem, tworząc odpowiednio halogenki, siarczki, azotki, fosforki, węgliki i krzemki:
wodorki, z halogenkami, siarką, azotem, fosforem, węglem i krzemem, tworząc odpowiednio halogenki, siarczki, azotki, fosforki, węgliki i krzemki:
Po podgrzaniu metale alkaliczne mogą reagować z innymi metalami, tworząc związki międzymetaliczne. Metale alkaliczne reagują aktywnie (wybuchowo) z kwasami.
Metale alkaliczne rozpuszczają się w ciekłym amoniaku i jego pochodnych - aminach i amidach:
Po rozpuszczeniu w ciekłym amoniaku metal alkaliczny traci elektron, który jest solwatowany przez cząsteczki amoniaku i nadaje roztworowi niebieski kolor. Powstałe amidy łatwo rozkładają się pod wpływem wody, tworząc zasady i amoniak:
Metale alkaliczne oddziałują z substancjami organicznymi, alkoholami (tworząc alkoholany) i kwasami karboksylowymi (tworząc sole):
4. Definicja jakościowa metale alkaliczne. Ponieważ potencjały jonizacji metali alkalicznych są małe, gdy metal lub jego związki są podgrzewane w płomieniu, atom ulega jonizacji, zabarwiając płomień na określony kolor:
|
Barwienie płomieniowe metalami alkalicznymi |
|
|
Karminowa czerwień |
|
|
Żółty |
|
|
Fioletowy |
|
|
Białawy różowy |
|
|
Fioletowo-czerwony |
|
Przygotowanie metali alkalicznych
1. Aby otrzymać metale alkaliczne, stosuje się głównie elektrolizę stopionych ich halogenków, najczęściej chlorków, które tworzą naturalne minerały:
katoda: Li+ + e → Lianoda: 2Cl- 2e → Cl22. Czasami przeprowadzają się w celu uzyskania metali alkalicznych
elektroliza stopów ich wodorotlenków:
katoda: Na+ + e → Naanoda: 4OH- 4e → 2H2O + O2 Ponieważ metale alkaliczne w szeregu napięcia elektrochemicznego znajdują się na lewo od wodoru, ich elektrolityczne wytwarzanie z roztworów soli jest niemożliwe; w tym przypadku powstają odpowiednie zasady i wodór.
W naturze metale alkaliczne występuje wyłącznie w postaci związków. Sód i potas są stałe komponenty wiele bardzo powszechnych krzemianów. Spośród poszczególnych minerałów sodu najważniejsza jest sól kuchenna (NaCl). woda morska a na niektórych obszarach powierzchni ziemi tworzy ogromne złoża tzw. soli kamiennej pod warstwą skał aluwialnych (w ZSRR - Solikamsk, Artemoven, Iletsk itp.). W górne warstwy W podobnych osadach występują niekiedy nagromadzenia soli potasowych [w postaci minerałów sylwinitu (KClNaCl), karnalitu (KCl MgCl2 · 6H2 O) itp.], które są głównym źródłem związków tego pierwiastka. Znanych jest jedynie kilka naturalnych nagromadzeń soli potasowych o znaczeniu przemysłowym. Najważniejszym z nich jest złoże Solikamsk w ZSRR.
Znanych jest wiele minerałów litu [na przykład spodumen LiAl (SiO3) 2 ], ale ich nagromadzenie jest rzadkie. Rubid i cez występują prawie wyłącznie jako zanieczyszczenia w innych metale alkaliczne. Ślady fransu zawsze znajdują się w rudach uranu.
Związki sodu i potasu mają ogromne znaczenie dla życia. Wystarczy przypomnieć, że człowiek zużywa rocznie 510 kg NaCl. Podobnie rośliny potrzebują soli potasowych. Pod tym względem około 90% wszystkich wydobywanych związków potasu wykorzystuje się do nawożenia gleb. Pozostałe 10%, a także ogromne ilości różnych związków sodu wykorzystuje się w przemyśle. Jak dotąd pochodne litu oraz bardzo ograniczone związki Rb i Cs znalazły jedynie stosunkowo niewielkie zastosowania.
W stanie wolnym metale alkaliczne można wydzielić przez elektrolizę ich stopionych soli chlorkowych. Sód ma podstawowe znaczenie praktyczne, którego roczna światowa produkcja przekracza 50 tysięcy ton.
Główna podgrupa grupy II obejmuje elementy bądź epu liy, magnez, wapń, stront, bar i rad. Wszystkie te pierwiastki, z wyjątkiem berylu, mają wyraźne właściwości metaliczne. Dostępny i reprezentują srebro Substancje rystobiałe, twardsze od metali alkalicznych, o dość wysokich temperaturach topnienia. Pod względem gęstości wszystkie, z wyjątkiem radu, należą do metali lekkich.
Dwóch pierwszych członków rozpatrywanej podgrupy zajmuje w niej dość szczególne miejsce, różniące się pod wieloma względami od pozostałych czterech elementów. B erillium według niektórych z nich jakość zbliża się do aluminium.
Wszystkie izotopy ostatniego pierwiastka podgrupy, radu, są radioaktywne. Izotop długowieczny 226 Ra dawniej stosowany w radioterapii; obecnie został zastąpiony tańszymi izotopami innych pierwiastków wytwarzanych w reaktorach jądrowych.
W zewnętrznej warstwie elektronowej atomy pierwiastków tej podgrupy mają dwa elektrony, w drugiej warstwie zewnętrznej beryl ma dwa elektrony, a pozostałe pierwiastki osiem.
Substancje proste utworzone z atomów tych pierwiastków to metale. Lit, sód, potas, rubid, cez i frans nazywane są metalami alkalicznymi, ponieważ ich wodorotlenki są zasadami. Wapń, stront i bar nazywane są metalami ziem alkalicznych. Aktywność chemiczna tych substancji wzrasta wraz ze wzrostem promienia atomowego. Spośród właściwości chemicznych tych metali najważniejsze są ich właściwości redukujące. Metale alkaliczne są najsilniejszymi środkami redukującymi. Metale pierwiastków grupy IIA są również dość silnymi reduktorami. Wszystkie (z wyjątkiem berylu) reagują z wodą (magnezem po ugotowaniu):
2M + 2H 2 O = 2M aq + 2OH aq + H 2,M + 2H 2 O = M 2 + 2OH + H 2.
W przypadku magnezu, wapnia i strontu, ze względu na małą rozpuszczalność powstających wodorotlenków, reakcji towarzyszy wytrącanie się osadu:
M2 + 2OH = Mg(OH) 2
Metale alkaliczne reagują z większością niemetali: 2M + H 2 = 2MH (po podgrzaniu), 4M + O 2 = 2M 2 O (M Li), 2 M + Cl 2 = 2MCl (w normalnych warunkach), 2M + S = M 2 S (po podgrzaniu).
Z metali alkalicznych po spaleniu w tlenie zwykły tlenek tworzy tylko lit. Pozostałe metale alkaliczne tworzą nadtlenki (M 2 O 2 ) lub ponadtlenki (MO 2
związki zawierające jon ponadtlenkowy z ładunkiem formalnym 1 e). Podobnie jak metale alkaliczne, metale pierwiastków grupy IIA reagują z wieloma niemetalami, ale w trudniejszych warunkach: M + H 2 = MH 2 (po podgrzaniu; z wyjątkiem berylu),
2M+O 2
= 2MO (w normalnych warunkach; Be i Mg po podgrzaniu), M + Cl 2 = MCl2 (w normalnych warunkach), M + S = MS (po podgrzaniu). W przeciwieństwie do metali alkalicznych tworzą z tlenem zwykłe tlenki. Tylko magnez i beryl reagują spokojnie z resztą kwasów; proste substancje bardzo gwałtownie, często z eksplozją Beryl reaguje ze stężonymi roztworami zasad: Be + 2OH+ 2H 2 O = 2 + H 2
Zgodnie z ich pozycją w szeregu napięcia, tylko beryl i magnez reagują z roztworami soli, pozostałe metale w tym przypadku reagują z wodą. Będąc silnymi środkami redukującymi, metale alkaliczne i ziem alkalicznych redukują ze swoich związków wiele mniej aktywnych metali, np. po podgrzaniu zachodzą następujące reakcje: 4Na + MnO 2 = 2Na2O + Mn;2Ca + SnO2 = 2CaO + Sn. Przemysłową metodą produkcji wszystkich metali alkalicznych i metali grupy IIA jest elektroliza stopionych soli.
Oprócz berylu tlenkami wszystkich rozważanych pierwiastków są tlenki zasadowe, a wodorotlenki mocnymi zasadami (w berylu związki te są amfoteryczne, wodorotlenek magnezu jest słabą zasadą). Wzmocnienie podstawowych właściwości wodorotlenków wraz ze wzrostem liczby atomowej pierwiastka w grupie można łatwo zaobserwować w szeregu wodorotlenków pierwiastków z grupy IIA. Być(OH) 2
wodorotlenek amfoteryczny, Mg(OH) 2
słaba zasada, Ca(OH) 2, Sr(OH) 2 i Ba(OH) 2 mocne zasady, ale wraz ze wzrostem liczby atomowej wzrasta ich rozpuszczalność, a Ba(OH) 2
można już zaliczyć do zasad.
Wszystkie metale ziem alkalicznych występują (w różnych ilościach) w przyrodzie. Ze względu na wysoką aktywność chemiczną nie wszystkie występują w stanie wolnym. Najpopularniejszym metalem ziem alkalicznych jest wapń, którego zawartość wynosi 3,38% (w przeliczeniu na masę skorupy ziemskiej). Jest nieco gorszy od magnezu, którego ilość wynosi 2,35% (masy skorupy ziemskiej). Bar i stront są również powszechne w przyrodzie i stanowią odpowiednio 0,05 i 0,034% masy skorupy ziemskiej. Beryl jest pierwiastkiem rzadkim, którego ilość wynosi 6 × 10−4% masy skorupy ziemskiej. Jeśli chodzi o rad, który jest radioaktywny, jest to najrzadszy ze wszystkich metali ziem alkalicznych, ale zawsze występuje w małych ilościach w rudach uranu. W szczególności można go stamtąd wyizolować chemicznie. Jego zawartość wynosi 1×10−10% (masy skorupy ziemskiej)/
Do pierwiastków p III grupy układu okresowego D.I. Mendelejewa należą: bor B, glin Al, gal Ga, ind In i tal Tl. Konfiguracja elektroniczna atomy ns2 np1 .
Poniżej porównano niektóre stałe charakteryzujące właściwości atomów pierwiastków p rozważanej grupy i odpowiednich substancji metalicznych:
Na właściwości pierwiastków p grupy III wpływa kompresja d (Al znajduje się w układ okresowy w małym III okresie oraz Ga, In i Tl w dużych okresach bezpośrednio po elementach d). Zatem od Al do Ga promień atomowy nieznacznie maleje, a pierwszy potencjał jonizacji wzrasta. Ponadto kompresja f wpływa również na właściwości atomów talu. Dlatego promień atomu Tl jest zbliżony do promienia atomu In, a energia jonizacji jest nieco większa.
Bor. Zgodnie ze strukturą elektronową atomu (1s2 2s2 2p1) bor może być jednowartościowy (jeden niesparowany elektron na podpoziomie energii 2p). Bor jest jednak najbardziej charakterystyczny dla związków, w których jest trójwartościowy (kiedy atom jest wzbudzony, w podpoziomach energii 2s i 2p znajdują się trzy niesparowane elektrony).
Wolny orbital 2p we wzbudzonym atomie boru determinuje właściwości akceptorowe wielu jego związków, w których tworzą się trzy wiązania kowalencyjne zgodnie z mechanizmem wymiany kowalencyjnej (np. Br3). Związki te mają skłonność do dodawania cząstek mających właściwości oddające elektrony, czyli do tworzenia kolejnego wiązania kowalencyjnego zgodnie z mechanizmem donor-akceptor. Na przykład:
BBr3 + Br- = [BBr4]-
Znane są dwa izotopy boru: 105 B (19,6%) i 11 5 B (80,4%). Jądra atomów izotopu (105 V) z łatwością absorbują neutrony:
105 V + 1 0 n = 4 2 He + 7 5 Li
Zdolność boru do pochłaniania neutronów determinuje jego zastosowanie w energetyce jądrowej: pręty sterujące reaktorów jądrowych są wykonane z materiałów zawierających bor.
Kryształy boru są czarne; są ogniotrwałe (tt 2300 ° C), diamagnetyczne i mają właściwości półprzewodnikowe (przerwa wzbroniona ΔE = 1,55 eV). Przewodność elektryczna boru, podobnie jak innych metali, jest niska i nieznacznie wzrasta wraz ze wzrostem temperatury.
Na temperatura pokojowa bor jest chemicznie obojętny i oddziałuje bezpośrednio tylko z fluorem; Po podgrzaniu bor utlenia się przez chlor, tlen i niektóre inne niemetale. Na przykład:
4B + 3O2 = 2B2O3
2В + ЗСl2 = 2ВСl3
W związkach z niemetalami stopień utlenienia boru wynosi +3; wszystkie te związki są kowalencyjne.
Trójtlenek boru B2 O3 jest substancją krystaliczną (t.t. 450°C, temperatura wrzenia 2250°C), charakteryzującą się wysokimi wartościami entalpii i energii tworzenia Gibbsa. Podczas interakcji z wodą B2 O3 przekształca się w kwas borowy:
B2O3 + ZH2O = 2H3BO3
H3 BO3 jest bardzo słabym (Kd ≈ 10-9) kwasem jednozasadowym. Dysocjację elektrolityczną H3 BO3 z eliminacją tylko jednego jonu H+ wyjaśniają opisane wcześniej właściwości akceptorowe boru: wolny orbital 2p atomu boru jest dostarczany donorowi elektronów OH-, powstałemu podczas dysocjacji cząsteczek H2O Proces przebiega według schematu
H3 BO3 + H2 O = H[B(OH)4 ] = H+ + [B(OH)4]-
Anion złożony [B(OH)4]- ma budowę tetraedryczną (sp3 – hybrydyzacja orbitali elektronowych). Właściwości akceptorowe boru w związkach o stopniu utlenienia + 3 przejawiają się także w chemii jego halogenków. Na przykład reakcje
BF3 + F- = -
BF3 + NH3 =
w którym wiązanie chemiczne pomiędzy BF i F- lub NH3 jest tworzone przez mechanizm donor-akceptor. Właściwość halogenków boru jako akceptorów elektronów determinuje ich szerokie zastosowanie jako katalizatory w reakcjach syntezy związków organicznych.
Bor nie oddziałuje bezpośrednio z wodorem, natomiast z metalami tworzy borki, zwykle związki niestechiometryczne Me4B, Me2B, MeB, Me3B4, MeB2 i MeB6.
Wodorki boru (borany) są bardzo trujące i mają bardzo nieprzyjemny zapach. Pozyskuje się je najczęściej pośrednio
podczas reakcji chemicznie aktywnych borków z kwasami lub halogenków boru z wodorkami metali alkalicznych:
6MgB2 + 12HCl = H2 + 8B + B4 H10 + 6MgCl2
8BF3 + 6LiH = B2H6 + 6LiBF4
Najprostszy związek boru z wodorem BH3 w normalnych warunkach nie istnieje, sp2 - Hybrydyzacja orbitali elektronowych w atomie boru prowadzi do koordynacyjnego nienasycenia cząstki BH3, w wyniku czego dwie takie cząstki łączą się w cząsteczkę diboranu: 2BH3 = B2H6 (ΔG0 298 = -127 kJ/mol).
W diboranie B2H6 bor znajduje się w stanie hybrydyzacji 5p3 i dla każdego atomu boru jeden z czterech orbitali hybrydowych jest pusty, a pozostałe trzy pokrywają się z s-orbitalami atomów wodoru. Wiązania pomiędzy grupami BH3 w cząsteczce B2H6 powstają w postaci wiązania wodorowego w wyniku przesunięcia gęstości elektronowej z jednego atomu wodoru grupy BH3 na pusty orbital innej grupy BH3. Znane są również inne borany, które można przedstawić za pomocą dwóch rzędów Bn Hn+4 i Bn Hn+6.
Borki metali S są reaktywne i często stosuje się je do wytwarzania mieszanin boranów w drodze obróbki kwasami. Większość borków metali d i f jest żaroodporna, bardzo twarda i stabilna chemicznie. Są szeroko stosowane bezpośrednio w postaci stopów do produkcji części silników odrzutowych i łopatek turbin gazowych. Niektóre borki służą do wytwarzania katod urządzeń elektronicznych.
Aluminium. Konfigurację elektronową atomu glinu wyraża się wzorem 1s2 2s2 2p6 3s2 3p1. Najbardziej zewnętrzna warstwa elektronowa atomu ma jeden niesparowany elektron:
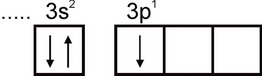
Dlatego aluminium może wykazywać wartościowość równą jedności. Jednak ta wartościowość nie jest typowa dla aluminium. We wszystkich stabilnych związkach stopień utlenienia aluminium wynosi +3. Wartościowość równa trzy odpowiada stanowi wzbudzonemu atomu Al:
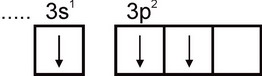
Pod względem liczebności aluminium zajmuje czwarte miejsce wśród wszystkich pierwiastków (po O, H i Si) i jest najpowszechniejszym metalem w przyrodzie. Większość aluminium koncentruje się w glinokrzemianach: skaleniach, mikach itp.
Aluminium srebrno-biały, lekki i niezwykle plastyczny metal o wysokiej przewodności cieplnej i elektrycznej.
Aluminium jest chemicznie aktywne; Reaguje z chlorem i bromem w temperaturze pokojowej oraz z jodem po podgrzaniu lub w obecności wody jako katalizatora. W temperaturze 800°C aluminium reaguje z azotem, a w temperaturze 2000°C z węglem. Aluminium wykazuje wysokie powinowactwo chemiczne do tlenu (ΔG0 298 = -1582 kJ/mol):
2Al + 0,502 = Al2O3, ΔH0 298 = -1650 kJ/mol
Na powietrzu aluminium pokrywa się bardzo trwałą, cienką (10-8 m) warstwą tlenku, która nieco osłabia metaliczny połysk aluminium. Dzięki powłoce tlenkowej powierzchnia aluminium zyskuje wysoką odporność na korozję. Przejawia się to przede wszystkim w obojętności aluminium na wodę i parę wodną. Dzięki utworzeniu filmu ochronnego aluminium jest odporne na działanie stężonych kwasów azotowych i siarkowych. Kwasy te pasywują aluminium na zimno. Tendencja do pasywacji umożliwia zwiększenie odporności aluminium na korozję poprzez obróbkę jego powierzchni silnymi utleniaczami (na przykład K2 Cr2 O7) lub zastosowanie utleniania anodowego. W tym przypadku grubość warstwy tlenku wzrasta do 3,10-5 m wysokie temperatury siła folii ochronnej gwałtownie spada. Jeśli uderzenie mechaniczne usuń warstwę tlenku, aluminium staje się wyjątkowo reaktywne. Reaguje energicznie z wodą i wodnymi roztworami kwasów i zasad, wypierając wodór i tworząc kationy lub aniony. Oddziaływanie glinu z roztworami kwasów przebiega zgodnie z równaniem reakcji
Al + 6H2O + 3H+ = [Al(H2O)6]3+ + 0,5H2
i roztworami alkalicznymi
Al + 3H2O + OH- = [Al(OH)4 ]- + 0,5H2
Kationy i aniony glinu łatwo przekształcają się w siebie, gdy zmienia się pH roztworu:
[Al(H2O)6 ]3+ + 4OH- = [Al(OH)4 ]- + 6H2O
[Al(OH)4 ]- + 4H+ + 2H2 O = [Al(H2O)6 ]3+
W roztworze mogą tworzyć się także związki mieszane, np. [Al(H2O)5 (OH)]2+ , [Al(H2O)4 (OH)2 ]+ , [Al(H2O)3 (OH)3 ] . Ten ostatni łatwo (zwłaszcza po podgrzaniu) odwadnia się i zamienia w wodorotlenek Al(OH)3:
[Al(H2O)3 (OH)3 ] = Al(OH)3 + 3H2O
Najszersze zastosowanie aluminium w technologii opiera się na jego cennych właściwościach fizycznych i fizycznych właściwości chemiczne i szeroko rozpowszechniony w skorupie ziemskiej. Ze względu na wysoką przewodność elektryczną (4,10-5 Ohm-1 cm-1) i małą gęstość stosowany jest do produkcji przewodów elektrycznych. Wysoka ciągliwość aluminium pozwala na wykonanie z niego najcieńszej folii, która stosowana jest w kondensatorach i zastępuje aluminium w osłonach kabli. Ze względu na brak magnesowalności stopy aluminium są stosowane w radiotechnice.
Większość aluminium wykorzystywana jest do produkcji stopów lekkich: duraluminium (94% Al, reszta Cu, Mg, Mn, Fe i Si), silumin (85 x 90% Al, 10 x 14% Si, reszta Na) itp. Aluminium stosuje się dodatkowo jako dodatek stopowy do stopów w celu nadania im odporności na ciepło. Aluminium i jego stopy zajmują jedno z głównych miejsc jako materiały konstrukcyjne w budowie samolotów, rakietach, inżynierii mechanicznej itp. Odporność na korozję aluminium (zwłaszcza anodowanego) znacznie przewyższa odporność na korozję stali. Dlatego jego stopy są stosowane jako materiały konstrukcyjne i w przemyśle stoczniowym. Z pierwiastkami d aluminium tworzy związki chemiczne - międzymetalidy (glinki): NiAl, Ni3 Al, CoAl itp., które są stosowane jako materiały żaroodporne. Aluminium wykorzystywane jest w aluminotermii do produkcji wielu metali oraz do spawania metodą termitową. Aluminotermia opiera się na wysokim powinowactwie aluminium do tlenu. Na przykład w reakcji przebiegającej według równania
8Al + 3Fe3 O4 = 4Al2 O3 + 9Fe
Wydziela się około 3500 kJ ciepła, a temperatura osiąga 3000°C.
Tlenek glinu znany jest w postaci kilku modyfikacji. Najbardziej stabilny jest α-Al2O3. Modyfikacja ta występuje w skorupie ziemskiej w postaci mineralnego korundu, z którego przygotowywane są tarcze szlifierskie i proszki ścierne. Zastosowanie korundu jako materiału ściernego opiera się na jego wysokiej twardości, ustępując jedynie twardości diamentu, karborundu SiC i borazonu BN. Przez fuzję Al2O3 z Cr2O3 otrzymuje się sztuczne rubiny. Służą do wykonywania kamieni podporowych w mechanizmach precyzyjnych. W ostatnio sztuczne rubiny stosuje się w generatorach kwantowych (laserach). Produkty wykonane z Al2O3 stosowane są jako materiały ogniotrwałe i dielektryki.
Związek polimerowy wodorotlenku glinu Al(OH)3. Posiada warstwową sieć krystaliczną. Każda warstwa składa się z oktaedrów Al(OH)6 (ryc. 1); Pomiędzy warstwami występuje wiązanie wodorowe. Wodorotlenek glinu otrzymywany w reakcji wymiany jest galaretowatym białym osadem, dobrze rozpuszczalnym w kwasach i zasadach. Stojąc, osad „starzeje się” i traci swoją aktywność chemiczną. Podczas kalcynowania wodorotlenek traci wodę i zamienia się w tlenek Al2O3. Jedna z postaci odwodnionego wodorotlenku, żel aluminiowy, stosowana jest w technologii jako adsorbent.
Niezwykle dużym zainteresowaniem cieszą się zeolity związków glinu, spokrewnione z glinokrzemianami. Ich skład można wyrazić ogólnym wzorem Meh Eu O2y ·nH2O, gdzie MeCa lub Na (rzadziej Ba, Sr, K); E Si i Al w zmiennym stosunku. Kryształy zeolitu mają kanały, przez które mogą przenikać cząsteczki H2O. Zawartość wody w zeolitach różni się znacznie w zależności od ciśnienia pary wodnej. Zeolity są zdolne do wymiany zawartej w nich wody na inne ciecze (alkohol itp.). Przy delikatnym ogrzewaniu woda jest stopniowo usuwana ze zeolitów. Ale nawet całkowite odwodnienie nie prowadzi do zniszczenia kryształów zeolitu. Kationy Ca2+ lub Na+ w zeolitach tworzą warstwę dyfuzyjną; nie są one utrwalone w sieci krystalicznej, ale wraz z wodą znajdują się w pustych przestrzeniach kryształu. Wyjaśnia to obecność w zeolitach właściwości kationowymiennych, ważnych ze względów technicznych. Możliwość zamiany niektórych kationów na inne pozwala na zastosowanie zeolitów jako wymieniaczy jonowych.
Jako tzw. sita molekularne wykorzystuje się szereg sztucznych zeolitów. Kryształy tych ostatnich charakteryzują się obecnością wąskich kanałów o średnicy od 3,10-10 do 13,10-10 m. Sita molekularne absorbują substancje, których cząsteczki mogą przedostać się przez te otwory.
Przykładowo sito molekularne o średnicy otworu 3,5 x 10-10 m może absorbować cząsteczki H2, O2, N2, ale nie absorbuje większych cząsteczek CH4 czy Ar. Za pomocą sit molekularnych można oddzielić węglowodory, suche gazy itp.
Gal, ind i tal w postaci prostych substancji to niskotopliwe srebrzystobiałe metale. Właściwości fizykochemiczne Ga, In i Tl znacznie różnią się od właściwości Al, pomimo podobieństwa budowy elektronowej poziomu energii zewnętrznej atomów rozpatrywanych pierwiastków.
Wynika to najwyraźniej z różnicy w strukturze elektronowej przedzewnętrznego poziomu energii atomów Al: (n-1)s2 (n-1)p6 z jednej strony i atomów Ga, In i Tl z drugiej: ( n-1)s2 (n- 1)р6 (n-1)d10 .
Stopień utlenienia galu i indu w stabilnych związkach wynosi +3. Stopień utlenienia +1 jest bardziej typowy dla talu. Związki talu, w których stopień utlenienia metalu wynosi +3, są silnymi utleniaczami.
Gal ma szeroki zakres temperatur istnienia w stanie ciekłym. Niska temperatura topnienia (około 30°C) i wysoka temperatura wrzenia (2205°C) umożliwiają wykorzystanie ciekłego galu do produkcji manometrów.
Ind równomiernie odbija fale świetlne o wszystkich długościach fal i dlatego jest stosowany w precyzyjnych instrumentach do produkcji luster. Ponadto In jest częścią niektórych stopów niskotopliwych.
Tal wprowadza się także do niektórych stopów, głównie z cyną i ołowiem (kwasoodpornych, łożyskowych).
Tlenki Ga2 O3, In2 O3 i Tl2 O3 są praktycznie nierozpuszczalne w wodzie. Zauważalny wzrost podstawowych właściwości w szeregu Ga2 O3 In2 O3 Tl2 O3 objawia się wzrostem rozpuszczalności tlenków w kwasach.
Wodorotlenki Ga(OH)3, In(OH)3, Tl(OH)3 są tak samo nierozpuszczalne w wodzie jak tlenki. Biały osad Ga(OH)3 jest rozpuszczalny jednakowo w kwasach i zasadach, a czerwonobrązowy Tl(OH)3 jest rozpuszczalny tylko w kwasach.
Gal i ind tworzą związki binarne typu AIII BV z pierwiastkami p z grupy V układu okresowego (na przykład GaP, GaAs, InSb itp.). W zdecydowanej większości związków typu AIII BV orbitale elektronowe są hybrydyzowane sp3; sieci krystaliczne tych związków mają strukturę charakteryzującą się czworościennym układem wiązań chemicznych. Wiele z tych związków diamentopodobnych to półprzewodniki. Wykorzystuje się je jako materiał na prostowniki prądu przemiennego, czujniki, generatory termoelektryczne itp.
Węgiel, krzem, german, cyna i ołów tworzą główną podgrupę grupy IV. Zewnętrzne poziomy energii pierwiastków p grupy IV zawierają cztery elektrony (konfiguracja ns2np2), z czego dwa to sparowane s-elektrony i dwa niesparowane p-elektrony.
W stanie niewzbudzonym elementy tej podgrupy wykazują wartościowość dwa. Po przejściu do stanu wzbudzonego, któremu towarzyszy przejście jednego z s-elektronów poziomu zewnętrznego do wolnej komórki podpoziomu p tego samego poziomu, wszystkie elektrony warstwy zewnętrznej stają się niesparowane, a wartościowość wzrasta do 4.
Mają także siarkę, selen, tellur i polon poziom zewnętrzny 6 elektronów (tj 2 s. 4 ), ale wszystkie mają niewypełniony poziom d, więc mogą mieć do 6 niesparowanych elektronów i wykazywać stopnie utlenienia -2, +4 i +6 w związkach.
Schemat zmian aktywności tych pierwiastków jest taki sam jak w podgrupie halogenów: najłatwiej utleniają się tellurki, następnie selenki i siarczki. Spośród tlenowych związków siarki najbardziej stabilne są związki siarki (VI), a dla telluru - związki telluru (IV). Związki selenu zajmują pozycję pośrednią.
W pierwiastkach podgrupy chromu poziom d jest wypełniony, dlatego na poziomie s ich atomów znajduje się 1 (dla chromu i molibdenu) lub 2 (dla wolframu) elektrony. Wszystkie wykazują maksymalny stopień utlenienia +6, jednak molibden, a zwłaszcza chrom, charakteryzują się związkami, w których mają niższy stopień utlenienia (+4 dla molibdenu i +3 lub +2 dla chromu). Związki chromu(III) są bardzo stabilne i podobne do związków glinu.
Wszystkie metale z podgrupy chromu są szeroko stosowane.
Molibden został po raz pierwszy uzyskany przez K. V. Scheele w 1778 roku. Wykorzystuje się go do produkcji stali o wysokiej wytrzymałości i ciągliwości, wykorzystywanych do produkcji luf broni, pancerzy, wałów itp.
Ze względu na zdolność odparowywania w wysokich temperaturach ma niewielkie zastosowanie do wytwarzania włókien, ale ma dobrą zdolność stapiania się ze szkłem, dlatego wykorzystuje się go do produkcji oprawek żarnika wolframowego w lampach żarowych.
Wolfram odkrył także K.V. Scheele w 1781 roku. Używa się go do produkcji stali specjalnych. Dodatek wolframu do stali zwiększa jej twardość, elastyczność i wytrzymałość. Wolfram wraz z chromem nadaje stali zdolność do utrzymywania twardości w bardzo wysokich temperaturach, dlatego właśnie takie stale wykorzystuje się do produkcji frezów do tokarek szybkoobrotowych.
Czysty wolfram ma najwyższą temperaturę topnienia spośród metali (3370 stopni C), dlatego wykorzystuje się go do produkcji włókien żarówek. Węglik wolframu ma bardzo wysoką twardość i odporność na ciepło i jest głównym integralna część stopy ogniotrwałe.
Podgrupa azotu składa się z pięciu pierwiastków: azotu, fosforu, arsenu, antymonu i bizmutu. Są to elementy p grupy V układu okresowego D. I. Mendelejewa.Na zewnętrznym poziomie energii atomy tych pierwiastków zawierają pięć elektronów, które mają konfigurację ns2np3 i są rozmieszczone następująco:
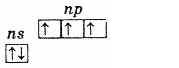
Dlatego najwyższy stopień utlenienia tych pierwiastków wynosi +5, najniższy -3, a charakterystyczna jest również obecność trzech niesparowanych elektronów na poziomie zewnętrznym, co wskazuje, że w stanie niewzbudnym atomy pierwiastków mają wartościowość. 3. Zewnętrzny poziom atomu azotu składa się tylko z dwóch podpoziomów 2s i 2p. Atomy pozostałych pierwiastków tej podgrupy mają charakter zewnętrzny poziomy energii są wolne komórki podpoziomu D. W konsekwencji jeden z s-elektronów poziomu zewnętrznego może po wzbudzeniu przejść do podpoziomu d tego samego poziomu, co prowadzi do powstania 5 niesparowanych elektronów.
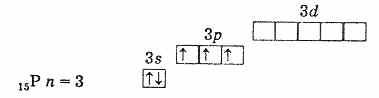
zewnętrzna powłoka elektronowa fosforu (atom niewzbudzony)
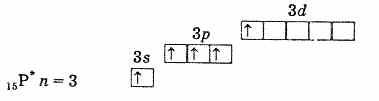
zewnętrzna powłoka elektronowa wzbudzonego atomu fosforu Zatem fosfor, arsen, antymon i bizmut w stanie wzbudzonym mają 5 niesparowanych elektronów, a ich wartościowość w tym stanie wynosi 5. Wzbudź elektron w atomie azotu. w podobny sposób jest niemożliwe ze względu na brak podpoziomu d na drugim poziomie. Dlatego azot nie może być pięciowartościowy, ale może tworzyć czwarte wiązanie kowalencyjne poprzez mechanizm donor-akceptor z powodu wolnej pary elektronów 2s2. Dla atomu azotu możliwy jest również inny proces. Kiedy jeden z dwóch elektronów 2s zostanie usunięty, azot staje się pojedynczo naładowanym czterowartościowym jonem N+.

Od azotu do bizmutu promień atomowy wzrasta, a potencjał jonizacji maleje. Właściwości redukujące atomów obojętnych rosną od N do Bi, a właściwości utleniające słabną (patrz tabela 21).
Z wodorem, azotem, fosforem i arsenem tworzą związki polarne RH3, wykazujące ujemny stopień utlenienia -3. Cząsteczki RH3 mają kształt piramidalny. W związkach tych wiązania pierwiastków z wodorem są silniejsze niż w odpowiednich związkach pierwiastków podgrupy tlenowej, a zwłaszcza podgrupy halogenowej. Dlatego związki wodorowe pierwiastków podgrupy azotu w roztworach wodnych nie tworzą jonów wodorowych.
W przypadku tlenu pierwiastki podgrupy azotu tworzą tlenki o ogólnym wzorze R2O3 i R2O5. Tlenki odpowiadają kwasom HRO2 i HRO3 (oraz ortokwasom H3RO4, z wyjątkiem azotu). W podgrupie charakter tlenków zmienia się następująco: tlenek kwasowy N2O3; Р4О6 słabo kwaśny tlenek; Amfoteryczny tlenek As2O3 o dominujących właściwościach kwasowych; Amfoteryczny tlenek Sb2O3 z dominującymi właściwościami zasadowymi; Zasadowy tlenek Bi2O3. Zatem właściwości kwasowe tlenków o składzie R2O3 i R2O5 zmniejszają się wraz ze wzrostem liczby atomowej pierwiastka, jak widać z tabeli. 21, w podgrupie od azotu do bizmutu właściwości niemetaliczne maleją, a właściwości metaliczne rosną. W antymonie właściwości te są wyrażone jednakowo; w bizmucie przeważają właściwości metaliczne; w azocie przeważają właściwości niemetaliczne. Fosfor, arsen i antymon tworzą kilka związków alotropowych.
Szósta grupa układu okresowego pierwiastków składa się z dwóch podgrup: grupy głównej - tlenu, siarki, selenu, telluru i polonu - oraz grupy wtórnej - chromu, molibdenu i wolframu. W podgrupie głównej wyróżnia się podgrupę selenu (selen, tellur i polon), podgrupę wtórną nazywa się podgrupą chromu. Wszystkie pierwiastki głównej podgrupy, z wyjątkiem tlenu, mogą dodać dwa elektrony, tworząc jony elektroujemne.
Elementy głównej podgrupy mają sześć elektronów (s2p4) na zewnętrznym poziomie elektronowym. Atomy tlenu mają dwa niesparowane elektrony i nie mają poziomu d. Dlatego tlen wykazuje głównie stopień utlenienia (2 i tylko w związkach z fluorem +2. Siarka, selen, tellur i polon również mają sześć elektronów na swoim poziomie zewnętrznym (s2p4), ale wszystkie mają niewypełniony poziom d, więc mogą mieć do sześciu niesparowanych elektronów i wykazywać w związkach stopnie utlenienia 2, +4 i +6.
Schemat zmian aktywności tych pierwiastków jest taki sam jak w podgrupie halogenów: najłatwiej utleniają się tellurki, następnie selenki i siarczki. Spośród tlenowych związków siarki najbardziej stabilne są związki siarki (VI), a w przypadku telluru związki telluru (IV). Związki selenu zajmują pozycję pośrednią.
Selen i tellur, a także ich związki z niektórymi metalami (indem, talem itp.) mają właściwości półprzewodnikowe i są szeroko stosowane w elektronice radiowej. Związki selenu i telluru są bardzo toksyczne. Są używane w przemysł szklarski do produkcji szkieł kolorowych (czerwonych i brązowych).
W pierwiastkach podgrupy chromu poziom d jest wypełniony, dlatego na poziomie s ich atomów znajduje się jeden (dla chromu i molibdenu) lub dwa (dla wolframu) elektrony. Wszystkie wykazują maksymalny stopień utlenienia +6, jednak molibden, a zwłaszcza chrom, charakteryzują się związkami, w których mają niższy stopień utlenienia (+4 dla molibdenu i +3 lub +2 dla chromu). Związki chromu(III) są bardzo stabilne i podobne do związków glinu. Wszystkie metale z podgrupy chromu są szeroko stosowane.
Molibden został po raz pierwszy uzyskany przez K.V. Scheele w 1778 roku. Wykorzystywany jest do produkcji stali o dużej wytrzymałości i ciągliwości, wykorzystywanych do produkcji luf broni, pancerzy, wałów itp. Ze względu na zdolność odparowywania w wysokich temperaturach jest mało przydatny do produkcji żarników, ale ma dobrą zdolność stapiania się ze szkłem, dlatego wykorzystuje się go do produkcji oprawek żarnika wolframowego w lampach żarowych.
Wolfram odkrył także K.V. Scheele w roku 178! d. Służy do produkcji stali specjalnych. Dodatek wolframu do stali zwiększa jej twardość, elastyczność i wytrzymałość. Wolfram wraz z chromem nadaje stali zdolność do utrzymywania twardości w bardzo wysokich temperaturach, dlatego właśnie takie stale wykorzystuje się do produkcji frezów do tokarek szybkoobrotowych. Czysty wolfram ma najwyższą temperaturę topnienia spośród metali (3370 (C), dlatego wykorzystuje się go do produkcji włókien żarówek. Węglik wolframu jest bardzo twardy i żaroodporny i jest głównym składnikiem stopów ogniotrwałych.
Pierwiastki zaliczane do VII grupy układu okresowego dzielą się na 2 podgrupy: główną – podgrupę halogenową – i drugorzędną – podgrupę manganu. Wodór również zalicza się do tej samej grupy, chociaż jego atom ma pojedynczy elektron na zewnętrznym poziomie walencyjnym i powinien być umieszczony w grupie I.
Jednakże wodór ma bardzo niewiele wspólnego zarówno z pierwiastkami podgrupy głównej – metalami alkalicznymi, jak i pierwiastkami podgrupy drugorzędnej – miedzią, srebrem i złotem. Jednocześnie, podobnie jak halogeny, dodaje elektron w reakcjach z aktywnymi metalami i tworzy wodorki, które mają pewne podobieństwa do halogenków.
Podgrupa halogenów obejmuje fluor, chlor, brom, jod i astat. Pierwsze 4 pierwiastki występują w przyrodzie, ostatni jest otrzymywany sztucznie i dlatego został zbadany znacznie rzadziej niż pozostałe halogeny. Słowo „halogen” oznacza tworzenie soli. Pierwiastki podgrupy otrzymały tę nazwę ze względu na łatwość, z jaką reagują z wieloma metalami, tworząc sole.
Wszystkie halogeny mają zewnętrzną strukturę powłoki elektronowej s 2p5 . Dlatego łatwo przyjmują elektron, tworząc stabilną powłokę elektronową gazu szlachetnego (s 2 r 6 ). Fluor ma najmniejszy promień atomowy w podgrupie, w pozostałych przypadkach zwiększa się w szeregu F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
Halogeny - bardzo aktywne elementy. Potrafią pobierać elektrony nie tylko z atomów, które łatwo je oddają, ale także z jonów, a nawet wypierać inne, mniej aktywne halogeny ze swoich związków. Na przykład fluor wypiera chlor z chlorków, brom z bromków i jod z jodków.
Ze wszystkich halogenów tylko fluor, który znajduje się w okresie II, nie ma niewypełnionego poziomu d. Z tego powodu nie może mieć więcej niż 1 niesparowanego elektronu i wykazuje jedynie wartościowość -1. W atomach innych halogenów poziom d nie jest wypełniony, co pozwala im mieć różną liczbę niesparowanych elektronów i wykazywać wartościowości -1, +1, +3, +5 i +7 obserwowane w związkach tlenu chlor, brom i jod.
Podgrupa manganu obejmuje mangan, technet i ren. W przeciwieństwie do halogenów pierwiastki podgrupy manganu posiadają tylko 2 elektrony na zewnętrznym poziomie elektronowym i dlatego nie wykazują zdolności przyłączania elektronów, tworząc ujemnie naładowane jony.
Mangan występuje powszechnie w przyrodzie i jest szeroko stosowany w przemyśle.
Technet jest radioaktywny, nie występuje w przyrodzie, ale został uzyskany sztucznie (pierwsi przez E. Segre i C. Perrier, 1937). Pierwiastek ten powstaje w wyniku radioaktywnego rozpadu uranu. Ren jest jednym z pierwiastków śladowych. Nie tworzy niezależnych minerałów, ale występuje jako towarzysz niektórych minerałów, zwłaszcza molibdenu.
Odkryli go V. i I. Noddakowie w 1925 roku. Stopy z niewielkimi dodatkami renu mają zwiększoną odporność na korozję. Dodatek renu do stopów zwiększa ich wytrzymałość mechaniczną.
Ta właściwość renu pozwala na jego użycie zamiast tego metal szlachetny iryd. Termopary platyna-platyna-ren działają lepiej niż termopary platyna-platyna-iryd, ale nie można ich stosować w bardzo wysokich temperaturach, ponieważ tworzy się lotny związek Re 2 O 7 .
Główną podgrupą ósmej grupy układu okresowego są gazy szlachetnehel, neon, argon, krypton, ksenon i radon. Pierwiastki te charakteryzują się bardzo niską aktywnością chemiczną, dlatego nazywa się je gazami szlachetnymi, czyli obojętnymi. Z trudem tworzą związki z innymi pierwiastkami lub substancjami; nie otrzymano związków chemicznych helu, neonu i argonu. Atomy gazów szlachetnych nie łączą się w cząsteczki, innymi słowy ich cząsteczki są jednoatomowe.
Gazy szlachetne kończą każdy okres układu pierwiastków. Z wyjątkiem helu wszystkie mają osiem elektronów w zewnętrznej warstwie elektronowej atomu, tworząc bardzo stabilny układ. Powłoka elektronowa helu, składająca się z dwóch elektronów, jest również stabilna. Dlatego atomy gazu szlachetnego charakteryzują się wysokimi energiami jonizacji i z reguły ujemnymi energiami powinowactwa elektronowego.
Od dawna wierzono, że atomy gazu szlachetnego na ogół nie są zdolne do tworzenia wiązań chemicznych z atomami innych pierwiastków. Znane były jedynie stosunkowo nietrwałe związki molekularne gazów szlachetnych, np. hydraty
Ag-6N 2 0, Kg-6N 2 0, Xe-6N 2 0, powstały w wyniku działania sprężonych gazów szlachetnych na krystalizującą przechłodzoną wodę. Hydraty te należą do typu klatratów; podczas tworzenia takich związków nie powstają wiązania walencyjne. Tworzeniu klatratów z wodą sprzyja obecność struktura krystaliczna lód licznych zagłębień.
Jednak w trakcie ostatnie dziesięciolecia stwierdzono, że krypton, ksenon i radon potrafią łączyć się z innymi pierwiastkami, a przede wszystkim z fluorem. Więc, ; fluorki otrzymywane są w wyniku bezpośredniego oddziaływania gazów szlachetnych z fluorem (poprzez ogrzewanie lub wyładowanie elektryczne) KrF 2, XeF 2, KrF 4, XeF 4 i RnF 4 . Wszystkie są kryształami stabilnymi w zwykłych warunkach. Pochodne ksenonu otrzymano także na stopniu utlenienia +6 heksafluorku XEF 6 , trójtlenek XeO3, wodorotlenek Xe(OH)b. Dwa ostatnie związki wykazują właściwości kwasowe; więc reagując z zasadami tworzą solekwas ksenonowy, na przykład: Xe0 3 + Ba(OH) 2 BaXe0 4 + H 2 0.
instrumenty pochodne; ksenon(VI)silne utleniacze. Jednakże pod wpływem jeszcze silniejszych środków utleniających można otrzymać związki, w których ksenon ma stopień utlenienia -4-8. Spośród tych związków znany jest oktafluorek Czterotlenek XeF 8, Xe0 4 i oksoheksafluorek XeOF 6.
Wyższą aktywność chemiczną kryptonu, ksenonu i radonu w porównaniu z pierwszymi członkami grupy gazów szlachetnych tłumaczy się stosunkowo niskim potencjałem jonizacyjnym ich atomów. W przypadku kryptonu, ksenonu i radonu wartości te są zbliżone do potencjałów jonizacyjnych niektórych innych pierwiastków (na przykład potencjał jonizacyjny atomu azotu wynosi 14,53 W, atom chloru 12,97 V).
Największy praktyczne zastosowanie Występują argon, neon i hel.
Wodór (łac. Wodór),H, pierwiastek chemiczny, pierwszy według liczby atomowej w układzie okresowym Mendelejewa; masa atomowa 1,0079. W normalnych warunkach wodór jest gazem; nie ma koloru, zapachu ani smaku.
Informacje historyczne.W pracach chemików z XVI i XVII wieku wielokrotnie wspominano o uwalnianiu się łatwopalnego gazu, gdy kwasy działają na metale. W 1766 r. G. Cavendish zebrał i zbadał uwolniony gaz, nazywając go „palnym powietrzem”. Będąc zwolennikiem teorii flogistonu, Cavendish uważał, że gaz ten jest czystym flogistonem. W 1783 r. A. Lavoisier poprzez analizę i syntezę wody udowodnił złożoność jej składu, a w 1787 r. zidentyfikował „powietrze palne” jako nowy pierwiastek chemiczny (wodór) i nadał mu nowoczesna nazwa wodoru (od greckiego hydor – woda i gennao – rodzę), co oznacza „rodzić wodę”; korzeń ten jest używany w nazwach związków wodoru i procesów z jego udziałem (na przykład wodorki, uwodornienie). Nowoczesną rosyjską nazwę „wodór” zaproponował M. F. Sołowjow w 1824 r.
Rozkład wodoru w przyrodzie.Wodór jest szeroko rozpowszechniony w przyrodzie; jego zawartość w skorupie ziemskiej (litosferze i hydrosferze) wynosi 1% masowy i 16% liczby atomów. Wodór jest częścią najpowszechniejszej substancji na Ziemi – wody (11,19% masowych wodoru), w składzie związków tworzących węgiel, ropę naftową, gazy ziemne, gliny, a także organizmy zwierzęce i roślinne (tj. skład białek, kwasów nukleinowych, tłuszczów, węglowodanów i innych). W stanie wolnym wodór jest niezwykle rzadki, m.in małe ilości występuje w gazach wulkanicznych i innych gazach naturalnych. W atmosferze obecne są niewielkie ilości wolnego wodoru (0,0001% liczby atomów). W przestrzeni bliskiej Ziemi wodór w postaci strumienia protonów tworzy wewnętrzny („protonowy”) pas radiacyjny Ziemi. W kosmosie najpowszechniej występującym pierwiastkiem jest wodór. W postaci plazmy stanowi około połowę masy Słońca i większości gwiazd, większość gazów ośrodka międzygwiazdowego i mgławic gazowych. Wodór występuje w atmosferze wielu planet i komet w postaci wolnego H 2, metan CH 4, amoniak NH 3, woda H 2 O, rodniki takie jak CH, NH, OH, SiH, PH itp. W postaci strumienia protonów wodór jest częścią korpuskularnego promieniowania Słońca i promienie kosmiczne.
Izotopy, atom i cząsteczka wodoru.Zwykły wodór składa się z mieszaniny 2 stabilnych izotopów: lekkiego wodoru lub protu ( 1 H) i ciężki wodór lub deuter ( 2 H lub D). W naturalnych związkach wodoru na 1 atom 2 H stanowi średnio 6800 atomów 1 H. Izotop promieniotwórczy o liczbie masowej 3 nazywany jest superciężkim wodorem lub trytem ( 3 H lub T), z miękkim promieniowaniem β i okresem półtrwania T½ = 12,262 lat. W naturze tryt powstaje na przykład z azotu atmosferycznego pod wpływem neutronów promieniowania kosmicznego; w atmosferze jest znikomy (4 10-15 % całkowitej liczby atomów wodoru). Otrzymano wyjątkowo niestabilny izotop 4 H. Liczby masowe izotopów 1 N, 2 N, 3 N i 4 Odpowiednio H, 1, 2, 3 i 4 wskazują, że jądro atomu protu zawiera tylko jeden proton, deuter - jeden proton i jeden neutron, tryt - jeden proton i 2 neutrony, 4 H - jeden proton i 3 neutrony. Duża różnica mas izotopów wodoru powoduje bardziej zauważalną różnicę w ich właściwościach fizykochemicznych niż w przypadku izotopów innych pierwiastków.
Atom wodoru ma najprostszą budowę spośród atomów wszystkich innych pierwiastków: składa się z jądra i jednego elektronu. Energia wiązania elektronu z jądrem (potencjał jonizacji) wynosi 13,595 eV. Neutralny atom wodoru może również dodać drugi elektron, tworząc jon ujemny H- w tym przypadku energia wiązania drugiego elektronu z atomem obojętnym (powinowactwo elektronowe) wynosi 0,78 eV. Mechanika kwantowa pozwala nam obliczyć wszystkie możliwe poziomy energii atomu wodoru, a tym samym dać pełną interpretację jego widma atomowego. Atom wodoru służy jako atom modelowy w obliczeniach mechaniki kwantowej poziomów energii innych, bardziej złożonych atomów.
Cząsteczka wodoru H 2 składa się z dwóch atomów połączonych wiązaniem kowalencyjnym wiązanie chemiczne. Energia dysocjacji (czyli rozpadu na atomy) wynosi 4,776 eV. Odległość międzyatomowa w położeniu równowagi jąder wynosi 0,7414 Å. W wysokich temperaturach cząsteczkowy wodór dysocjuje na atomy (stopień dysocjacji w temperaturze 2000°C wynosi 0,0013, w temperaturze 5000°C 0,95). Wodór atomowy powstaje również w różnych postaciach reakcje chemiczne(na przykład wpływ Zn na kwas solny). Jednak istnienie wodoru w stanie atomowym trwa tylko krótki czas, atomy łączą się ponownie w cząsteczki H 2 .
Właściwości fizyczne wodoru.Wodór jest najlżejszą ze znanych substancji (14,4 razy lżejszą od powietrza), a jej gęstość wynosi 0,0899 g/l przy 0°C i 1 atm. Wodór wrze (skrapla) i topi się (zestala) odpowiednio w temperaturach -252,8°C i -259,1°C (tylko hel ma więcej niskie temperatury topienie i gotowanie). Temperatura krytyczna wodoru jest bardzo niska (-240°C), dlatego jego upłynnienie jest obarczone dużymi trudnościami; ciśnienie krytyczne 12,8 kgf/cm 2 (12,8 atm), gęstość krytyczna 0,0312 g/cm 3 . Ze wszystkich gazów wodór ma najwyższą przewodność cieplną, wynoszącą 0,174 W/(m·K) w temperaturze 0°C i pod ciśnieniem 1 atmosfery, czyli 4,16 · 10-4 cal/(s·cm·°С). Ciepło właściwe wodoru w temperaturze 0°C i 1 atm C P 14,208 kJ/(kg·K), czyli 3,394 cal/(g°C). Wodór jest słabo rozpuszczalny w wodzie (0,0182 ml/g w temperaturze 20°C i 1 atm), ale dobrze rozpuszczalny w wielu metalach (Ni, Pt, Pa i innych), zwłaszcza w palladzie (850 objętości na 1 objętość Pd). Rozpuszczalność wodoru w metalach jest związana z jego zdolnością do dyfuzji przez nie; Dyfuzji przez stop węgla (na przykład stal) towarzyszy czasami zniszczenie stopu w wyniku interakcji wodoru z węglem (tzw. Dekarbonizacja). Ciekły wodór jest bardzo lekki (gęstość w -253°C 0,0708 g/cm3). 3 ) i płyn (lepkość w -253°C 13,8 spoise).
Właściwości chemiczne wodoru.W większości związków wodór wykazuje wartościowość (dokładniej stopień utlenienia) +1, podobnie jak sód i inne metale alkaliczne; jest zwykle uważany za analog tych metali, należący do I grupy układu okresowego. Jednak w wodorkach metali jon wodorowy jest naładowany ujemnie (stan utlenienia -1), to znaczy wodorek Na+H- zbudowany jak chlorek sodu+ Cl - . To i kilka innych faktów (bliskość właściwości fizyczne Wodór i halogeny, zdolność halogenów do zastąpienia wodoru w związkach organicznych) dają podstawę do zaklasyfikowania wodoru także do VII grupy układu okresowego. W zwykłych warunkach wodór molekularny jest stosunkowo mało aktywny, łącząc się bezpośrednio tylko z najbardziej aktywnymi niemetalami (z fluorem, a w świetle z chlorem). Jednak po podgrzaniu reaguje z wieloma pierwiastkami. Wodór atomowy ma zwiększoną aktywność chemiczną w porównaniu z wodorem molekularnym. Z tlenem wodór tworzy wodę:
H 2 + 1/2 O 2 = H 2 O
z wydzieleniem 285,937 kJ/mol, czyli 68,3174 kcal/mol ciepła (w temperaturze 25°C i 1 atm.). Na normalne temperatury reakcja przebiega niezwykle powoli, powyżej 550°C – z eksplozją. Granice wybuchowości mieszaniny wodoru i tlenu wynoszą (objętościowo) od 4 do 94% H 2 i mieszanina wodór-powietrze - od 4 do 74% H 2 (mieszanka 2 tomów H 2 i 1 tom O 2 zwany gazem detonującym). Wodór służy do redukcji wielu metali, ponieważ usuwa tlen z ich tlenków:
CuO + H2 = Cu + H2O,
Fe 3 O 4 + 4H 2 = 3Fe + 4H 2 O itd.
Z halogenami Wodór tworzy halogenowodory, na przykład:
H2 + Cl2 = 2HCl.
Jednocześnie wodór eksploduje fluorem (nawet w ciemności i temperaturze -252°C), reaguje z chlorem i bromem dopiero po oświetleniu lub podgrzaniu, a z jodem dopiero po podgrzaniu. Wodór reaguje z azotem tworząc amoniak:
ZN2 + N2 = 2NH3
tylko na katalizatorze i w podwyższonych temperaturach i ciśnieniach. Po podgrzaniu wodór reaguje energicznie z siarką:
H 2 + S = H 2 S (siarkowodór),
znacznie trudniejsze w przypadku selenu i telluru. Wodór może reagować z czystym węglem bez katalizatora tylko w wysokich temperaturach:
2H 2 + C (amorficzny) = CH 4 (metan).
Wodór reaguje bezpośrednio z niektórymi metalami (alkalicznymi, ziem alkalicznych i innymi), tworząc wodorki:
H2+2Li = 2LiH.
Duże znaczenie praktyczne mają reakcje wodoru z tlenkiem węgla (II), w wyniku których powstają różne związki organiczne, w zależności od temperatury, ciśnienia i katalizatora, np. HCHO, CH 3 ON i inni. Węglowodory nienasycone reagują z wodorem, stając się nasycone, na przykład:
do n H. 2n + H. 2 = do n H. 2n+2.
Rola wodoru i jego związków w chemii jest wyjątkowo duża. Wodór decyduje o właściwościach kwasowych tzw. kwasów protonowych. Wodór ma tendencję do tworzenia z niektórymi pierwiastkami tzw. wiązań wodorowych, co ma decydujący wpływ na właściwości wielu związków organicznych i nieorganicznych.
Otrzymywanie wodoru.Głównymi rodzajami surowców do przemysłowej produkcji wodoru są naturalne gazy palne, gaz koksowniczy i gazy rafinacyjne. Wodór pozyskuje się także z wody metodą elektrolizy (w miejscach, w których jest tani prąd). Najważniejszymi metodami wytwarzania wodoru z gazu ziemnego są katalityczne oddziaływanie węglowodorów, głównie metanu, z parą wodną (konwersja):
CH 4 + H 2 O = CO + ZN 2,
i niecałkowite utlenianie węglowodorów tlenem:
CH 4 + 1/2 O 2 = CO + 2H 2
Powstały tlenek węgla (II) również ulega konwersji:
CO + H 2 O = CO 2 + H 2.
Wodór produkowany z gazu ziemnego jest najtańszy.
Wodór izoluje się z gazu koksowniczego i gazów rafinacyjnych poprzez usunięcie pozostałych składników mieszaniny gazów, które podczas głębokiego chłodzenia upłynniają się łatwiej niż wodór. Elektrolizę wody przeprowadza się prądem stałym, przepuszczając ją przez roztwór KOH lub NaOH (nie stosuje się kwasów, aby uniknąć korozji sprzętu stalowego). W laboratoriach wodór otrzymuje się przez elektrolizę wody, a także w wyniku reakcji pomiędzy cynkiem i kwas chlorowodorowy. Częściej jednak wykorzystują w butlach gotowy wodór.
Zastosowanie wodoru.Wodór zaczęto produkować na skalę przemysłową pod koniec XVIII wieku do napełniania balony. Obecnie wodór ma szerokie zastosowanie w przemyśle chemicznym, głównie do produkcji amoniaku. Głównym konsumentem wodoru jest także produkcja alkoholi metylowych i innych, benzyny syntetycznej i innych produktów otrzymywanych w drodze syntezy z wodoru i tlenku węgla (II). Wodór stosowany jest do uwodornienia paliw stałych i ciężkich ciekłych, tłuszczów i innych, do syntezy HCl, do hydrorafinacji produktów naftowych, przy spawaniu i cięciu metali płomieniem tlenowo-wodorowym (temperatura do 2800°C) oraz w spawaniu atomowo-wodorowym (do 4000°C). Izotopy wodoru – deuter i tryt – znalazły bardzo ważne zastosowania w energetyce jądrowej.
Właściwości chemiczne pierwiastków Strona 13
Chemia jest nauką zajmującą się badaniem pierwiastków chemicznych, prostych i złożonych substancji, jakie tworzą (skład, struktura, właściwości), ich przemian i praw, jakim te przemiany podlegają. Dzieli się na nieorganiczne, organiczne, fizyczne, analityczne, koloidalne itp. Nowoczesna chemia jest połączona z innymi naukami, w wyniku czego powstają graniczne dziedziny nauki: biochemia, agrochemia, kosmochemia, radiochemia itp. Osiągnięcia współczesnej chemii są bodźcem intensywny wzrost przemysł chemiczny, zabawa ważną rolę w postępie naukowo-technicznym wszystkich gałęzi przemysłu gospodarka narodowa. Chemia odgrywa ważną rolę w rozwiązywaniu najbardziej palących i obiecujących problemów nowoczesne społeczeństwo(zwiększanie efektywności i bezpieczeństwa stosowania nawozów sztucznych w celu zwiększenia plonów produktów rolnych oraz problematyka syntezy produktów spożywczych z surowców niespożywczych; rozwój oceanicznych źródeł surowców; rozwój i tworzenie nowych źródeł energii; synteza nowych substancje i kompozycje niezbędne do rozwiązania problemów w przyszłości; środowisko). Patrz nr 2, s. 334.
Przedmiotem badań w chemii są pierwiastki chemiczne i ich związki. Pierwiastek chemiczny to zbiór atomów równy ładunek rdzenie. Z kolei atom to najmniejsza cząsteczka pierwiastka chemicznego, która zachowuje wszystkie swoje właściwości chemiczne. Zatem każdy pierwiastek chemiczny odpowiada określonemu typowi atomu. Patrz nr 3, s.11.
Cząsteczka to najmniejsza cząsteczka pojedynczej substancji, zdolna do samodzielnego istnienia, posiadająca podstawowe właściwości chemiczne i składająca się z identycznych lub różnych atomów. Cząsteczki mogą być jedno-, dwu- lub wieloatomowe. Są to cząstki składowe materii. Jeśli cząsteczki składają się z identycznych atomów, wówczas substancję nazywa się prostą lub elementarną, na przykład He, Ar, H2, O2, O3, S4, P4. Substancja prosta jest formą istnienia pierwiastka chemicznego w stanie wolnym. Patrz nr 3, s. 11, s. 12.
Jeśli cząsteczka substancji składa się z różnych atomów, wówczas substancję nazywa się kompleksem (lub związkiem chemicznym), na przykład CO, H2O, NH3, H3PO4. Każda substancja charakteryzuje się określonym składem (rodzajem i liczbą atomów w cząsteczce), strukturą (rozmieszczeniem przestrzennym atomów w cząsteczce) oraz określonymi właściwościami fizycznymi i chemicznymi. Patrz nr 3, s.12.
Właściwości chemiczne substancji charakteryzują jej zdolność do uczestniczenia w reakcjach chemicznych, czyli w procesach przekształcania jednych substancji w inne. Aby zrozumieć te właściwości, należy poznać skład i strukturę substancji. Patrz nr 3, s.12.
Cały układ okresowy można podzielić na metale, niemetale i substancje amfoteryczne. Metale- substancje proste charakteryzujące się zdolnością do oddawania elektronów znajdujących się na zewnętrznym poziomie energii (elektrony walencyjne) i przekształcania się w jony naładowane dodatnio. Prawie wszystkie metale mają wysoką przewodność elektryczną i cieplną, zdolność dobrego odbijania fal świetlnych (co decyduje o ich połysku i nieprzezroczystości) oraz plastyczność. W stanie stałym mają zazwyczaj strukturę krystaliczną. Połączenie między atomami metalu odbywa się za pomocą elektronów walencyjnych, które poruszają się swobodnie w sieci krystalicznej utworzonej przez dodatnio naładowane jony metali. Spośród 107 pierwiastków układu okresowego 83 to metale. Wiele właściwości użytkowych metali zależy nie tylko od ich właściwości chemicznych, ale także od struktury, jaką uzyskują w wyniku metod produkcji i późniejszej obróbki. Stwarza to możliwości szerokiej zmiany właściwości metali i czyni je najważniejszymi materiałami konstrukcyjnymi, elektrycznymi, mechanicznymi i innymi. Obecnie metale są szeroko stosowane w różnych dziedzinach techniki. Niemetale- substancje proste, które nie są plastyczne, metaliczny połysk, są słabymi przewodnikami ciepła i elektryczności. Atomy niemetali charakteryzują się przede wszystkim zdolnością do przyłączania elektronów, tj. zamieniają się w ujemnie naładowane jony. Do niemetali zaliczamy 22 pierwiastki: H, B, C, Si, N, P, As, O, S, Se, Te, halogeny i gazy szlachetne. Tlenki niemetali mają charakter kwasowy; odpowiadają kwasom zawierającym tlen. Substancje amfoteryczne- substancje wykazujące tendencję do wykazywania zarówno właściwości kwasowych, jak i zasadowych. Substancja amfoteryczna reagując np. z mocną zasadą może wykazywać właściwości kwasowe, natomiast jednocześnie ta sama substancja reagując z mocnym kwasem może wykazywać właściwości zasadowe. Patrz nr 2, s. 273, s. 279, s. 225.
Rozważmy układ okresowy pierwiastków chemicznych. Został stworzony w oparciu o prawo okresowości. Tabela składa się z 7 okresów i 8 grup.
Okresy to poziome rzędy stołu, podzielone są na duże i małe. W okresach mydlanych występują 2 elementy (okres 1.) lub 8 elementów (okres 2. i 3.), w okresach dużych 18 elementów (okres 4. i 5.) lub 32 elementy (okres 6.). Siódmy okres jeszcze się nie skończył. Każdy okres zaczyna się od typowego metalu, a kończy na typowym niemetalu i gazie szlachetnym. Patrz nr 1, s. 271.
Kolumny pionowe nazywane są grupami elementów. Każda grupa jest podzielona na dwie podgrupy: główną i drugorzędną. Podgrupa to zbiór pierwiastków będących analogami chemicznymi. Często elementy podgrupy mają najwyższy stopień utlenianie odpowiadające numerowi grupy. Patrz nr 1, s. 271.
W głównych podgrupach właściwości chemiczne pierwiastków mogą się znacznie różnić
„Chemia. 9. klasa.” OS Gabrieljan (GDZ)
Charakterystyka pierwiastków chemicznych. Okresowe prawo Mendelejewa
Pytanie 1.
Prawo okresowości Mendelejewa jest jednym z podstawowych praw chemii. Można argumentować, że wszystko współczesna chemia na tym zbudowany. Wyjaśnia zależność właściwości atomów od ich budowy, uogólnia tę zależność na wszystkie pierwiastki, dzieląc je na różne grupy, a także przewiduje ich właściwości w zależności od struktury i strukturę w zależności od właściwości.
Istnieją inne prawa, które pełnią funkcje wyjaśniające, uogólniające i predykcyjne. Na przykład prawo zachowania energii, prawo załamania światła, prawo genetyczne Mendla, prawo uniwersalna grawitacja itp.
Pytanie 2.
Kierując się układem okresowym, znajdziemy pierwiastek o pożądanym ułożeniu elektronów na poziomach energetycznych (2 i 5). Tym pierwiastkiem jest azot: N: 1s 2 2s 2 2p 3.
Pierwiastek ten tworzy prostą substancję - N 2, azot. Wodór związek azotu - NH 3, amoniak. Najwyższy tlenek azotu to N2O5. Tlenek ten należy do tlenków kwasowych, gdyż po rozpuszczeniu w wodzie staje się mocny kwas azotowy HNO3.
N 2 O 5 + H 2 O = 2HNO 3;
N2O5 + BaO = Ba(OH)2;
N 2 O 5 + Ba(OH) 2 = Ba(NO 3) 2 + H 2 O;
Azot na stopniu utlenienia +5 (N +5) posiada silne właściwości utleniające:
2N 2 O 5 + 5C = 2N 2 + 5CO 2.
Pytanie 3.
Wcześniej błędnie przypisywano pierwiastkowi beryl III grupa. Powodem tego było błędne określenie masy atomowej berylu (zamiast 9 uznano ją za równą 13,5). DI. Mendelejew zasugerował, że beryl należy do grupy II, na podstawie właściwości chemicznych pierwiastka. Właściwości berylu były bardzo podobne do właściwości magnezu (Mg) i wapnia (Ca), a zupełnie odmienne od aluminium (Al). Wiedząc, że masy atomowe Li i B, sąsiadujących pierwiastków z Be, wynoszą odpowiednio 7 i 11, D.I. Mendelejew założył, że masa atomowa berylu wynosi 9.
Pytanie 4.
Ca to atom, którego elektrony są rozmieszczone szeregowo
liczby 2, 8, 8, 2.
Element nr 7-N,
element nr 8 - O.
Równania reakcji:
3Ca + N 2 = Ca 3 N 2,
2Ca + O2 = 2CaO.
Produkty reakcji mają typ wiązania jonowego.
Azot i tlen mają strukturę molekularną sieci krystaliczne, a wapń ma metalową sieć krystaliczną.
Produkty interakcji - Ca 3 N 2 i CaO - mają strukturę jonowej sieci krystalicznej.
Pytanie 5.
N, P, As, Sb, Bi – wzmocnienie właściwości metalicznych.
Właściwości metaliczne grup są ulepszone.
Pytanie 6.
W szeregu pierwiastków: N, Mg, Al, Si, P, S, Cl - wzmocnienie właściwości niemetalicznych.
Właściwości niemetaliczne pierwiastków rosną wraz z okresami.
Pytanie 7.
Cl 2 O 7, P 2 O 5, SiO 2, Al 2 O 3, MgO, Na 2 O – obniżenie właściwości kwasowych.
Właściwości kwasu zwiększają się podczas okresów.
HClO 4, H3PO 4, H 2 SO 4, Al(OH) 3, NaOH – obniżenie właściwości kwasowych.
Pytanie 8.
B 2 O 3 , BeO, Li 2 O – wzrost podstawowych właściwości.
B(OH) 3, Be(OH) 2, LiOH - wzrost właściwości zasadowych.
B(OH) 3 – słaby kwas;
Be(OH) 2 - słaba zasada;
LiOH jest mocną zasadą.
Pytanie 9.
Układ okresowy pierwiastków odzwierciedla związek pierwiastków chemicznych. Liczba atomowa pierwiastka jest równa ładunkowi jądra, a liczbowo jest równa liczbie protonów. Liczba neutronów zawartych w jądrach jednego pierwiastka, w przeciwieństwie do liczby protonów, może być różna. Atomy jednego pierwiastka, których jądra zawierają inny numer neutrony nazywane są izotopami.
Każdy pierwiastek chemiczny ma kilka izotopów (naturalnych lub uzyskanych sztucznie). Masa atomowa pierwiastka chemicznego jest równa średniej wartości mas wszystkich jego naturalnych izotopów, biorąc pod uwagę ich liczebność.
Wraz z odkryciem izotopów do rozmieszczenia pierwiastków w układzie okresowym zaczęto wykorzystywać ładunki jąder, a nie ich masy atomowe.
Pytanie 10.
Dzieje się tak, ponieważ właściwości pierwiastków i ich związków nie zależą od całkowitej liczby elektronów, a jedynie od liczby elektronów walencyjnych, które znajdują się w ostatniej warstwie. Liczba elektronów walencyjnych zmienia się okresowo, dlatego okresowo zmieniają się również właściwości pierwiastków.
Pytanie 11.
1. Właściwości pierwiastków chemicznych i substancji przez nie utworzonych zależą okresowo od względnych mas atomowych pierwiastków.
2. Właściwości pierwiastków chemicznych i substancji przez nie utworzonych okresowo zależą od ładunku jąder atomowych pierwiastków.














