หัวข้อ: คุณสมบัติทางเคมีขององค์ประกอบ
วางแผน:
1. คุณสมบัติของโลหะและสารประกอบ (บทที่ 1 และ 2 กลุ่มย่อย)
1.1 องค์ประกอบ IA
1.2 องค์ประกอบของ IIA ลักษณะทั่วไปของกลุ่ม
2. คุณสมบัติทางเคมีของธาตุ
2.1 องค์ประกอบ IIIA ลักษณะทั่วไปของกลุ่ม
2.2 องค์ประกอบของ IVA ลักษณะทั่วไปของกลุ่ม
2.3 องค์ประกอบ VA ลักษณะทั่วไปของกลุ่ม
2.4 องค์ประกอบ VIA ลักษณะทั่วไปของกลุ่ม
2.5 องค์ประกอบของ VIIA ลักษณะทั่วไปของกลุ่ม
2.6 องค์ประกอบของ VIIIA ลักษณะทั่วไปของกลุ่ม
3.ไฮโดรเจน
องค์ประกอบโลหะอัลคาไลของกลุ่มย่อยหลักของกลุ่ม I ของตารางธาตุของ D. I. Mendeleev: ลิเธียม Li, โซเดียม Na, โพแทสเซียม K, รูบิเดียม Rb, ซีเซียม Cs และแฟรนเซียม Fr. โลหะเหล่านี้เรียกว่าโลหะอัลคาไลน์เนื่องจากสารประกอบส่วนใหญ่ละลายในน้ำได้ ในภาษาสลาฟ "ชะล้าง" หมายถึง "ละลาย" ซึ่งเป็นตัวกำหนดชื่อของโลหะกลุ่มนี้ เมื่อโลหะอัลคาไลละลายในน้ำ จะเกิดไฮดรอกไซด์ที่ละลายน้ำได้เรียกว่าอัลคาลิส G. Davy เป็นคนแรกที่ได้รับโพแทสเซียมและโซเดียมฟรีในปี 1807
ในชั้นอิเล็กตรอนชั้นนอก อะตอมของโลหะอัลคาไลจะมีอิเล็กตรอนอย่างละหนึ่งตัว ในชั้นอิเล็กตรอนชั้นนอกชั้นที่สอง อะตอมลิเธียมประกอบด้วยอิเล็กตรอนสองตัว และอะตอมของโลหะอัลคาไลที่เหลือจะมีอิเล็กตรอนแปดตัวแต่ละตัว การมีอิเล็กตรอนเพียงตัวเดียวในชั้นอิเล็กตรอนด้านนอก ซึ่งอยู่ห่างจากนิวเคลียสค่อนข้างมาก อะตอมขององค์ประกอบเหล่านี้จึงปล่อยอิเล็กตรอนตัวนี้ค่อนข้างง่าย กล่าวคือ พวกมันมีลักษณะเฉพาะด้วยพลังงานไอออไนเซชันต่ำ ไอออนบวกที่มีประจุเดี่ยวที่เกิดขึ้นในกรณีนี้มีโครงสร้างอิเล็กทรอนิกส์ที่เสถียรของก๊าซมีตระกูลที่เกี่ยวข้อง (โครงสร้างลิเธียมไอออนของอะตอมฮีเลียม อะตอมนีออนโซเดียมไอออน ฯลฯ) ความง่ายในการให้อิเล็กตรอนภายนอกเป็นลักษณะขององค์ประกอบที่ได้รับการพิจารณาว่าเป็นตัวแทนของโลหะโดยทั่วไป: คุณสมบัติของโลหะจะเด่นชัดเป็นพิเศษในโลหะอัลคาไล
โครงสร้างที่เหมือนกันไม่เพียงแต่ด้านนอกเท่านั้น แต่ยังรวมถึงชั้นอิเล็กทรอนิกส์สุดท้ายของอะตอมของโลหะอัลคาไลทั้งหมด ยกเว้นลิเธียม เป็นตัวกำหนดความคล้ายคลึงกันอย่างมากของคุณสมบัติขององค์ประกอบเหล่านี้ ในเวลาเดียวกันการเพิ่มขึ้นของประจุนิวเคลียร์และจำนวนอิเล็กตรอนทั้งหมดในอะตอมเมื่อเคลื่อนที่จากบนลงล่างผ่านกลุ่มย่อยทำให้เกิดความแตกต่างในคุณสมบัติของพวกมัน เช่นเดียวกับในกลุ่มอื่นๆ ความแตกต่างเหล่านี้แสดงให้เห็นโดยหลักคือความสะดวกในการบริจาคเวเลนซ์อิเล็กตรอนที่เพิ่มขึ้น และคุณสมบัติทางโลหะที่เพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
|
คุณสมบัติของโลหะอัลคาไล |
||||||||
|
อะตอม |
ชื่อ, |
โลหะ |
อิออน |
ศักยภาพ |
อีโอ |
พี |
ทีพีแอล, |
ไม่เป็นไร |
|
ลิเธียม ลี |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
โซเดียมนา |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
โพแทสเซียมเค |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
รูบิเดียม Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
ซีเซียมซี |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
คุณสมบัติทางเคมีของโลหะอัลคาไล เนื่องจากโลหะอัลคาไลมีฤทธิ์ทางเคมีสูงเมื่อเทียบกับน้ำ ออกซิเจน และไนโตรเจน จึงถูกเก็บไว้ใต้ชั้นน้ำมันก๊าด เพื่อทำปฏิกิริยากับโลหะอัลคาไลเป็นชิ้นๆ ขนาดที่เหมาะสมตัดอย่างระมัดระวังด้วยมีดผ่าตัดภายใต้ชั้นของน้ำมันก๊าดในบรรยากาศอาร์กอนพื้นผิวของโลหะจะถูกทำความสะอาดอย่างทั่วถึงของผลิตภัณฑ์ที่มีปฏิสัมพันธ์กับอากาศจากนั้นจึงวางตัวอย่างไว้ในถังปฏิกิริยาเท่านั้น
1. ปฏิกิริยากับน้ำ คุณสมบัติที่สำคัญของโลหะอัลคาไลพวกเขา กิจกรรมสูงที่เกี่ยวข้องกับน้ำ ลิเธียมทำปฏิกิริยากับน้ำอย่างสงบที่สุด (ไม่มีการระเบิด):
เมื่อเกิดปฏิกิริยาที่คล้ายกัน โซเดียมจะไหม้เป็นเปลวไฟสีเหลืองและเกิดการระเบิดเล็กน้อย โพแทสเซียมมีความกระฉับกระเฉงยิ่งขึ้น: ในกรณีนี้การระเบิดจะรุนแรงขึ้นมากและเปลวไฟก็มีสี สีม่วง- 2. ปฏิกิริยากับออกซิเจน ผลิตภัณฑ์ที่เกิดจากการสันดาปของโลหะอัลคาไลในอากาศได้ องค์ประกอบที่แตกต่างกันขึ้นอยู่กับกิจกรรมของโลหะ
มีเพียงลิเธียมเท่านั้นที่เผาไหม้ในอากาศเพื่อสร้างออกไซด์ขององค์ประกอบปริมาณสัมพันธ์:
เมื่อโซเดียมไหม้ Na2O2 เปอร์ออกไซด์ส่วนใหญ่จะก่อตัวขึ้นด้วยส่วนผสมเล็กน้อยของ NaO2 ซูเปอร์ออกไซด์:
ผลิตภัณฑ์จากการเผาไหม้ของโพแทสเซียม รูบิเดียม และซีเซียม มีซูเปอร์ออกไซด์เป็นส่วนใหญ่: ![]()
เพื่อให้ได้โซเดียมและโพแทสเซียมออกไซด์ ส่วนผสมของไฮดรอกไซด์ เปอร์ออกไซด์ หรือซูเปอร์ออกไซด์ที่มีโลหะส่วนเกินจะถูกให้ความร้อนในกรณีที่ไม่มีออกซิเจน: 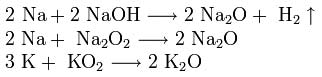
รูปแบบต่อไปนี้เป็นคุณลักษณะของสารประกอบออกซิเจนของโลหะอัลคาไล: เมื่อรัศมีของไอออนบวกของโลหะอัลคาไลเพิ่มขึ้น ความเสถียรของสารประกอบออกซิเจนที่มีเปอร์ออกไซด์ไอออน O22 และซูเปอร์ออกไซด์ไอออน O2- จะเพิ่มขึ้น
โลหะอัลคาไลหนักมีลักษณะเฉพาะคือการก่อตัวของโอโซนที่มีความเสถียรพอสมควรโดยมีองค์ประกอบเป็น EO3 สารประกอบออกซิเจนทั้งหมดมีสีที่แตกต่างกัน โดยความเข้มจะเข้มขึ้นตามลำดับตั้งแต่ Li ถึง Cs:
|
สูตร |
สี |
|
Li2O |
สีขาว |
|
นา2O |
สีขาว |
|
เคทูโอ |
สีเหลือง |
|
Rb2O |
สีเหลือง |
|
ซีเอสทูโอ |
ส้ม |
|
นา2O2 |
แสงสว่าง |
|
เคโอ 2 |
ส้ม |
|
RbO2 |
มืด- |
|
CsO2 |
สีเหลือง |
ออกไซด์ของโลหะอัลคาไลมีคุณสมบัติทั้งหมดของออกไซด์พื้นฐาน: พวกมันทำปฏิกิริยากับน้ำ ออกไซด์ที่เป็นกรด และกรด: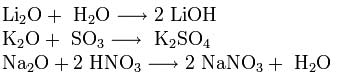
เปอร์ออกไซด์และซูเปอร์ออกไซด์แสดงคุณสมบัติของสารออกซิไดซ์ที่แรง:
เปอร์ออกไซด์และซูเปอร์ออกไซด์ทำปฏิกิริยากับน้ำอย่างเข้มข้นทำให้เกิดไฮดรอกไซด์:
3. ปฏิกิริยากับสารอื่นๆ โลหะอัลคาไลทำปฏิกิริยากับอโลหะหลายชนิด เมื่อถูกความร้อนจะรวมตัวกับไฮโดรเจนเพื่อก่อตัว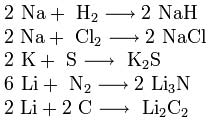 ไฮไดรด์ โดยมีฮาโลเจน ซัลเฟอร์ ไนโตรเจน ฟอสฟอรัส คาร์บอน และซิลิคอน เพื่อสร้างเฮไลด์ ซัลไฟด์ ไนไตรด์ ฟอสไฟด์ คาร์ไบด์ และซิลิไซด์ตามลำดับ:
ไฮไดรด์ โดยมีฮาโลเจน ซัลเฟอร์ ไนโตรเจน ฟอสฟอรัส คาร์บอน และซิลิคอน เพื่อสร้างเฮไลด์ ซัลไฟด์ ไนไตรด์ ฟอสไฟด์ คาร์ไบด์ และซิลิไซด์ตามลำดับ:
เมื่อถูกความร้อน โลหะอัลคาไลสามารถทำปฏิกิริยากับโลหะอื่น ๆ ก่อตัวเป็นสารประกอบระหว่างโลหะ โลหะอัลคาไลทำปฏิกิริยาอย่างแข็งขัน (ระเบิด) กับกรด
โลหะอัลคาไลละลายในแอมโมเนียเหลวและอนุพันธ์ - เอมีนและเอไมด์:
เมื่อละลายในแอมโมเนียเหลว โลหะอัลคาไลจะสูญเสียอิเล็กตรอน ซึ่งถูกละลายโดยโมเลกุลแอมโมเนีย และทำให้สารละลายมีสีฟ้า เอไมด์ที่ได้จะถูกย่อยสลายได้ง่ายด้วยน้ำเพื่อสร้างเป็นด่างและแอมโมเนีย:
โลหะอัลคาไลทำปฏิกิริยากับสารอินทรีย์ แอลกอฮอล์ (เพื่อสร้างแอลกอฮอล์) และกรดคาร์บอกซิลิก (เพื่อสร้างเกลือ):
4. คำจำกัดความเชิงคุณภาพโลหะอัลคาไล เนื่องจากศักยภาพในการแตกตัวเป็นไอออนของโลหะอัลคาไลมีน้อย เมื่อโลหะหรือสารประกอบของมันถูกให้ความร้อนในเปลวไฟ อะตอมจึงถูกแตกตัวเป็นไอออน ทำให้เปลวไฟมีสีที่ต้องการ:
|
การระบายสีเปลวไฟด้วยโลหะอัลคาไล |
|
|
สีแดงเลือดนก |
|
|
สีเหลือง |
|
|
สีม่วง |
|
|
ขาวอมชมพู |
|
|
สีม่วง-แดง |
|
การเตรียมโลหะอัลคาไล
1. เพื่อให้ได้โลหะอัลคาไล พวกเขาส่วนใหญ่ใช้อิเล็กโทรไลซิสของการละลายของเฮไลด์ ซึ่งส่วนใหญ่มักจะเป็นคลอไรด์ที่ก่อตัวเป็นแร่ธาตุธรรมชาติ:
แคโทด: Li+ + e → Lianode: 2Cl- 2e → Cl22 บางครั้งเพื่อให้ได้โลหะอัลคาไลที่พวกเขาทำ
อิเล็กโทรไลซิสของการละลายของไฮดรอกไซด์:
แคโทด: Na+ + e → Naanode: 4OH- 4e → 2H2O + O2 เนื่องจากโลหะอัลคาไลในชุดแรงดันไฟฟ้าเคมีไฟฟ้าตั้งอยู่ทางด้านซ้ายของไฮโดรเจน การผลิตด้วยไฟฟ้าจากสารละลายเกลือจึงเป็นไปไม่ได้ ในกรณีนี้จะเกิดอัลคาไลและไฮโดรเจนที่สอดคล้องกัน
ในธรรมชาติ โลหะอัลคาไลพบเฉพาะในรูปของสารประกอบเท่านั้น โซเดียมและโพแทสเซียมมีค่าคงที่ ส่วนประกอบซิลิเกตทั่วไปหลายชนิด ในบรรดาแร่ธาตุโซเดียมแต่ละชนิด ที่สำคัญที่สุดคือเกลือแกง (NaCl) น้ำทะเลและในบางพื้นที่ของพื้นผิวโลกจะก่อให้เกิดสิ่งที่เรียกว่าเกลือสินเธาว์จำนวนมากใต้ชั้นหินลุ่มน้ำ (ในสหภาพโซเวียต - Solikamsk, Artemoven, Iletsk ฯลฯ ) ใน ชั้นบนเงินฝากที่คล้ายกันบางครั้งมีการสะสมของเกลือโพแทสเซียม [ในรูปของแร่ธาตุซิลวิไนต์ (KClNaCl), คาร์นัลไลต์ (KCl MgCl2 6H2 O) ฯลฯ ] ซึ่งทำหน้าที่เป็นแหล่งหลักของสารประกอบขององค์ประกอบนี้ มีการสะสมเกลือโพแทสเซียมตามธรรมชาติที่มีความสำคัญทางอุตสาหกรรมเพียงเล็กน้อยเท่านั้น สิ่งที่สำคัญที่สุดคือสนาม Solikamsk ในสหภาพโซเวียต
แร่ธาตุหลายชนิดขึ้นชื่อในเรื่องลิเธียม [เช่น สปอดูมีน LiAl (SiO3) 2 ] แต่การสะสมของพวกมันนั้นหาได้ยาก รูบิเดียมและซีเซียมเกิดขึ้นเกือบทั้งหมดในฐานะสิ่งเจือปนในสิ่งเจือปนอื่นๆ โลหะอัลคาไล- ร่องรอยของแฟรนเซียมมักพบในแร่ยูเรเนียม
สารประกอบโซเดียมและโพแทสเซียมมีความสำคัญอย่างยิ่งต่อชีวิต พอจะระลึกได้ว่าคนเราบริโภค NaCl 510 กิโลกรัมต่อปี ในทำนองเดียวกันพืชก็ต้องการเกลือโพแทสเซียม ในเรื่องนี้ประมาณ 90% ของสารประกอบโพแทสเซียมที่ขุดได้ทั้งหมดจะถูกนำมาใช้ในการปฏิสนธิในดิน ส่วนที่เหลืออีก 10% รวมถึงสารประกอบโซเดียมต่างๆ จำนวนมากถูกนำมาใช้ในอุตสาหกรรม จนถึงขณะนี้ อนุพันธ์ของลิเธียมและสารประกอบ Rb และ Cs ที่จำกัดมาก พบว่ามีเพียงการใช้งานที่ค่อนข้างเล็กเท่านั้น
ในรัฐอิสระ โลหะอัลคาไลสามารถแยกออกได้โดยอิเล็กโทรไลซิสของเกลือคลอไรด์หลอมเหลว โซเดียมมีความสำคัญในทางปฏิบัติเบื้องต้นซึ่งมีการผลิตทั่วโลกต่อปีมากกว่า 50,000 ตัน
กลุ่มย่อยหลักของกลุ่ม II ประกอบด้วยองค์ประกอบบี เอปู ลี, แมกนีเซียม, แคลเซียม, สตรอนเซียม, แบเรียมและเรเดียม องค์ประกอบทั้งหมดเหล่านี้ ยกเว้นเบริลเลียม มีคุณสมบัติเป็นโลหะเด่นชัด มีอยู่และเป็นตัวแทนของเงิน สาร Rhysto-white แข็งกว่าโลหะอัลคาไล มีจุดหลอมเหลวค่อนข้างสูง ในแง่ของความหนาแน่น ทั้งหมดยกเว้นเรเดียมเป็นของโลหะเบา
สมาชิกสองคนแรกของกลุ่มย่อยที่อยู่ระหว่างการพิจารณามีตำแหน่งที่ค่อนข้างพิเศษซึ่งแตกต่างหลายประการจากองค์ประกอบทั้งสี่อื่น ๆ บีเอริลเลียมตามบางชนิดของมันเอง คุณภาพกำลังเข้าใกล้อลูมิเนียม.
ไอโซโทปทั้งหมดขององค์ประกอบสุดท้ายของกลุ่มย่อยเรเดียมมีกัมมันตภาพรังสี ไอโซโทปที่มีอายุยืนยาว 226 รา เดิมใช้ในการฉายรังสี; ปัจจุบันถูกแทนที่ด้วยไอโซโทปที่ถูกกว่าของธาตุอื่นๆ ที่ผลิตในเครื่องปฏิกรณ์นิวเคลียร์
ในชั้นอิเล็กตรอนชั้นนอก อะตอมของธาตุในกลุ่มย่อยนี้มีอิเล็กตรอนสองตัว ในชั้นนอกที่สอง เบริลเลียมมีอิเล็กตรอนสองตัว และองค์ประกอบที่เหลือมีแปดตัว
สารเชิงเดี่ยวที่เกิดจากอะตอมของธาตุเหล่านี้คือโลหะ ลิเธียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม เรียกว่าโลหะอัลคาไล เนื่องจากไฮดรอกไซด์ของพวกมันคือด่าง แคลเซียม สตรอนเทียม และแบเรียมเรียกว่าโลหะอัลคาไลน์เอิร์ธ กิจกรรมทางเคมีของสารเหล่านี้เพิ่มขึ้นเมื่อรัศมีอะตอมเพิ่มขึ้น คุณสมบัติทางเคมีของโลหะเหล่านี้คุณสมบัติที่สำคัญที่สุดคือคุณสมบัติรีดิวซ์ โลหะอัลคาไลเป็นสารรีดิวซ์ที่แข็งแกร่งที่สุด โลหะของธาตุหมู่ IIA ก็มีสารรีดิวซ์ที่ค่อนข้างแรงเช่นกัน ทั้งหมด (ยกเว้นเบริลเลียม) ทำปฏิกิริยากับน้ำ (แมกนีเซียมเมื่อต้ม):
2M + 2H 2 O = 2M aq + 2OH aq + H 2,M + 2H 2 O = M 2 + 2OH + H 2
ในกรณีของแมกนีเซียม แคลเซียม และสตรอนเทียม เนื่องจากความสามารถในการละลายของไฮดรอกไซด์ที่เกิดขึ้นต่ำ ปฏิกิริยาจะมาพร้อมกับการก่อตัวของตะกอน:
ม2 + 2OH = มก.(OH) 2
โลหะอัลคาไลทำปฏิกิริยากับอโลหะส่วนใหญ่: 2M + H 2 = 2MH (เมื่อถูกความร้อน), 4M + O 2 = 2M 2 O (M Li), 2M + Cl 2 = 2MCl (ภายใต้สภาวะปกติ), 2M + S = M 2 S (เมื่อถูกความร้อน)
ในบรรดาโลหะอัลคาไล เมื่อเผาในออกซิเจน ออกไซด์ตามปกติจะเกิดเป็นลิเธียมเท่านั้น โลหะอัลคาไลที่เหลือจะเกิดเป็นเปอร์ออกไซด์ (M 2 โอ 2 ) หรือซูเปอร์ออกไซด์ (MO 2
สารประกอบที่มีไอออนซูเปอร์ออกไซด์ซึ่งมีประจุอย่างเป็นทางการ 1 e) เช่นเดียวกับโลหะอัลคาไล โลหะของธาตุกลุ่ม IIA ทำปฏิกิริยากับอโลหะหลายชนิด แต่ภายใต้สภาวะที่รุนแรงกว่า: M + H 2 = MH 2 (เมื่อได้รับความร้อน ยกเว้นเบริลเลียม)
2เอ็ม+โอ 2
= 2MO (ภายใต้สภาวะปกติ เป็น และ Mg เมื่อถูกความร้อน), M + Cl 2 = เอ็มซีแอล 2 (ภายใต้สภาวะปกติ), M + S = MS (เมื่อถูกความร้อน) ต่างจากโลหะอัลคาไลตรงที่พวกมันสร้างออกไซด์ธรรมดาด้วยออกซิเจน มีเพียงแมกนีเซียมและเบริลเลียมเท่านั้นที่ทำปฏิกิริยากับกรดอย่างสงบ สารง่ายๆรุนแรงมากมักเกิดการระเบิด เบริลเลียมทำปฏิกิริยากับสารละลายเข้มข้นของด่าง: Be + 2OH+ 2H 2 O = 2 + H 2
ตามตำแหน่งในซีรีย์แรงดันไฟฟ้า มีเพียงเบริลเลียมและแมกนีเซียมเท่านั้นที่ทำปฏิกิริยากับสารละลายเกลือ โลหะที่เหลือในกรณีนี้จะทำปฏิกิริยากับน้ำ โลหะอัลคาไลและอัลคาไลน์เอิร์ทเป็นสารรีดิวซ์ที่รุนแรงจะช่วยลดโลหะที่มีฤทธิ์น้อยกว่าจากสารประกอบ เช่น เมื่อถูกความร้อนจะเกิดปฏิกิริยาต่อไปนี้: 4Na + MnO 2 = 2Na 2 O + Mn; 2Ca + SnO 2 = 2CaO + Sn วิธีการผลิตทางอุตสาหกรรมที่พบได้ทั่วไปในโลหะอัลคาไลและโลหะกลุ่ม IIA ทั้งหมดคือการอิเล็กโทรไลซิสของเกลือหลอมเหลว
นอกจากเบริลเลียมแล้ว ออกไซด์ขององค์ประกอบทั้งหมดที่อยู่ระหว่างการพิจารณายังเป็นออกไซด์พื้นฐาน และไฮดรอกไซด์เป็นเบสแก่ (ในเบริลเลียมสารประกอบเหล่านี้เป็นแอมโฟเทอริก แมกนีเซียมไฮดรอกไซด์เป็นเบสอ่อน) การเสริมสร้างคุณสมบัติพื้นฐานของไฮดรอกไซด์ด้วยการเพิ่มเลขอะตอมขององค์ประกอบในกลุ่มนั้นสังเกตได้ง่ายในชุดไฮดรอกไซด์ขององค์ประกอบกลุ่ม IIA เป็น(OH) 2
แอมโฟเทอริกไฮดรอกไซด์, Mg(OH) 2
ฐานอ่อน Ca(OH) 2, ซีเนียร์(OH) 2 และบา(OH) 2 เบสแก่ แต่เมื่อเลขอะตอมเพิ่มขึ้น ความสามารถในการละลายก็เพิ่มขึ้น และ Ba(OH) 2
สามารถจัดเป็นด่างได้แล้ว
โลหะอัลคาไลน์เอิร์ททั้งหมดพบได้ในธรรมชาติ (ในปริมาณที่ต่างกัน) เนื่องจากมีฤทธิ์ทางเคมีสูง จึงไม่พบทั้งหมดในรัฐอิสระ โลหะอัลคาไลน์เอิร์ทที่พบมากที่สุดคือแคลเซียม ซึ่งมีปริมาณ 3.38% (โดยน้ำหนักของเปลือกโลก) ด้อยกว่าแมกนีเซียมเล็กน้อยซึ่งมีปริมาณ 2.35% (ของมวลเปลือกโลก) แบเรียมและสตรอนเซียมก็พบได้ทั่วไปในธรรมชาติ โดยคิดเป็น 0.05 และ 0.034% ของมวลเปลือกโลก ตามลำดับ เบริลเลียมเป็นองค์ประกอบที่หายากซึ่งมีปริมาณ 6 × 10−4% ของมวลเปลือกโลก สำหรับเรเดียมซึ่งมีกัมมันตภาพรังสีนั้น เป็นโลหะที่หายากที่สุดในบรรดาโลหะอัลคาไลน์เอิร์ธ แต่จะพบได้ในปริมาณเล็กน้อยในแร่ยูเรเนียม โดยเฉพาะอย่างยิ่งสามารถแยกได้จากที่นั่นทางเคมี เนื้อหาคือ 1×10−10% (ของมวลเปลือกโลก)/
ธาตุ p ของกลุ่มที่ 3 ของตารางธาตุของ D.I. Mendeleev ได้แก่ โบรอน B, อะลูมิเนียม Al, แกลเลียม Ga, อินเดียม อิน และแทลเลียม Tl การกำหนดค่าทางอิเล็กทรอนิกส์อะตอม ns2 np1 .
ด้านล่างนี้เป็นการเปรียบเทียบค่าคงที่บางส่วนที่แสดงลักษณะของอะตอมขององค์ประกอบ p ของกลุ่มที่พิจารณาและสารโลหะที่เกี่ยวข้อง:
คุณสมบัติขององค์ประกอบ p กลุ่ม III ได้รับผลกระทบจากการบีบอัด d (Al อยู่ใน ตารางธาตุในช่วง III เล็ก และ Ga, In และ Tl ในช่วงใหญ่หลังจากองค์ประกอบ d) ดังนั้นรัศมีอะตอมจาก Al ถึง Ga จะลดลงเล็กน้อย และศักยภาพไอออไนเซชันแรกจะเพิ่มขึ้น นอกจากนี้ การบีบอัดแบบ f ยังส่งผลต่อคุณสมบัติของอะตอมแทลเลียมด้วย นั่นเป็นเหตุผลว่าทำไมรัศมีของอะตอม Tl จึงใกล้กับรัศมีของอะตอม In และพลังงานไอออไนเซชันจะสูงขึ้นเล็กน้อย
บ. ตามโครงสร้างอิเล็กทรอนิกส์ของอะตอม (1s2 2s2 2p1) โบรอนสามารถเป็นโมโนวาเลนต์ได้ (อิเล็กตรอนที่ไม่จับคู่หนึ่งตัวที่ระดับย่อยพลังงาน 2p) อย่างไรก็ตาม โบรอนเป็นคุณลักษณะส่วนใหญ่ของสารประกอบที่เป็นไตรวาเลนต์ (เมื่ออะตอมถูกกระตุ้น จะมีอิเล็กตรอนที่ไม่จับคู่กัน 3 ตัวในระดับย่อยพลังงาน 2s และ 2p)
วงโคจรอิสระ 2p ในอะตอมโบรอนที่ถูกตื่นเต้นจะกำหนดคุณสมบัติตัวรับของสารประกอบหลายชนิด โดยพันธะโควาเลนต์สามพันธะจะเกิดขึ้นตามกลไกการแลกเปลี่ยนโควาเลนต์ (เช่น Br3) สารประกอบเหล่านี้มีแนวโน้มที่จะเพิ่มอนุภาคที่มีคุณสมบัติในการบริจาคอิเล็กตรอน เช่น การก่อตัวของพันธะโควาเลนต์อื่นตามกลไกของผู้บริจาคและผู้รับ ตัวอย่างเช่น:
BBr3 + Br- = [BBr4 ]-
รู้จักโบรอนสองไอโซโทป: 105 B (19.6%) และ 11 5 B (80.4%) นิวเคลียสของอะตอมของไอโซโทป (105 V) ดูดซับนิวตรอนได้ง่าย:
105 V + 1 0 n = 4 2 เขา + 7 5 Li
ความสามารถของโบรอนในการดูดซับนิวตรอนเป็นตัวกำหนดการใช้งานในพลังงานนิวเคลียร์ แท่งควบคุมของเครื่องปฏิกรณ์นิวเคลียร์ทำจากวัสดุที่มีโบรอน
ผลึกโบรอนมีสีดำ เป็นวัสดุทนไฟ (mp 2300 °C) แม่เหล็ก และมีคุณสมบัติเซมิคอนดักเตอร์ (ช่องว่างของแถบความถี่ ΔE = 1.55 eV) ค่าการนำไฟฟ้าของโบรอนก็เหมือนกับโลหะอื่นๆ ที่มีค่าการนำไฟฟ้าต่ำและเพิ่มขึ้นเล็กน้อยเมื่ออุณหภูมิเพิ่มขึ้น
ที่ อุณหภูมิห้องโบรอนเป็นสารเคมีเฉื่อยและมีปฏิกิริยาโดยตรงกับฟลูออรีนเท่านั้น เมื่อถูกความร้อน โบรอนจะถูกออกซิไดซ์โดยคลอรีน ออกซิเจน และอโลหะอื่นๆ ตัวอย่างเช่น:
4B + 3O2 = 2B2 O3
2В + ЗСl2 = 2ВСl3
ในสารประกอบที่ไม่ใช่โลหะ สถานะออกซิเดชันของโบรอนคือ +3; สารประกอบทั้งหมดนี้เป็นโคเวเลนต์
โบรอนไตรออกไซด์ B2 O3 เป็นสารผลึก (mp 450 °C, จุดเดือด 2250 °C) โดดเด่นด้วยค่าเอนทัลปีและพลังงานการก่อตัวกิ๊บส์สูง เมื่อทำปฏิกิริยากับน้ำ B2 O3 จะเปลี่ยนเป็น กรดบอริก:
B2 O3 + ZH2 O = 2H3 BO3
H3 BO3 เป็นกรดโมโนเบสิกที่อ่อนแอมาก (Kd µ 10-9) การแยกตัวด้วยไฟฟ้าของ H3 BO3 ด้วยการกำจัด H+ ไอออนเพียงตัวเดียวนั้นอธิบายได้โดยคุณสมบัติตัวรับที่อธิบายไว้ก่อนหน้านี้ของโบรอน: วงโคจรอิสระ 2p ของอะตอมโบรอนนั้นมอบให้กับผู้บริจาคอิเล็กตรอน OH- ซึ่งเกิดขึ้นระหว่างการแยกตัวของโมเลกุล H2 O . กระบวนการดำเนินไปตามโครงการ
H3 BO3 + H2 O = H[B(OH)4 ] = H+ + [B(OH)4]-
ไอออนเชิงซ้อน [B(OH)4] มีโครงสร้างทรงสี่หน้า (sp3 ไฮบริดไดเซชันของออร์บิทัลอิเล็กทรอนิกส์) คุณสมบัติตัวรับของโบรอนในสารประกอบที่มีสถานะออกซิเดชัน + 3 ก็แสดงออกมาในทางเคมีของเฮไลด์เช่นกัน ตัวอย่างเช่นปฏิกิริยา
BF3 + F- = -
BF3 + NH3 =
ซึ่งพันธะเคมีระหว่าง BF และ F- หรือ NH3 เกิดขึ้นจากกลไกของผู้บริจาคและผู้รับ คุณสมบัติของโบรอนเฮไลด์ในการเป็นตัวรับอิเล็กตรอนจะเป็นตัวกำหนด ประยุกต์กว้างเป็นตัวเร่งปฏิกิริยาในปฏิกิริยาการสังเคราะห์สารประกอบอินทรีย์
โบรอนไม่มีปฏิกิริยาโดยตรงกับไฮโดรเจน แต่กับโลหะจะเกิดโบไรด์ ซึ่งมักจะเป็นสารประกอบที่ไม่ใช่ปริมาณสารสัมพันธ์ Me4B, Me2B, MeB, Me3B4, MeB2 และ MeB6
โบรอนไฮไดรด์ (boranes) มีพิษมากและมีมาก กลิ่นเหม็น- พวกเขาได้รับทางอ้อมบ่อยที่สุด
เมื่อทำปฏิกิริยาโบไรด์ที่ออกฤทธิ์ทางเคมีกับกรดหรือโบรอนเฮไลด์กับไฮไดรด์ของโลหะอัลคาไล:
6MgB2 + 12HCl = H2 + 8B + B4 H10 + 6MgCl2
8BF3 + 6LiH = B2 H6 + 6LiBF4
สารประกอบโบรอนที่ง่ายที่สุดกับไฮโดรเจน BH3 ไม่มีอยู่ภายใต้สภาวะปกติ sp2 - การผสมพันธุ์ของออร์บิทัลของอิเล็กตรอนในอะตอมโบรอนนำไปสู่การประสานความไม่อิ่มตัวของอนุภาค BH3 ซึ่งเป็นผลมาจากการที่อนุภาคทั้งสองดังกล่าวรวมกันเป็นโมเลกุลไดโบเรน: 2BH3 = B2 H6 (ΔG0 298 = -127 กิโลจูล/ โมล)
ในไดโบเรน B2H6 โบรอนอยู่ในสถานะไฮบริดไดเซชัน 5p3 และสำหรับอะตอมโบรอนแต่ละอะตอม หนึ่งในสี่ออร์บิทัลลูกผสมจะว่างเปล่า และอีกสามออร์บิทัลทับซ้อนกันด้วย s-ออร์บิทัลของอะตอมไฮโดรเจน พันธะระหว่างหมู่ BH3 ในโมเลกุล B2H6 ก่อตัวขึ้นเป็นพันธะไฮโดรเจน เนื่องจากความหนาแน่นของอิเล็กตรอนเปลี่ยนจากอะตอมไฮโดรเจนหนึ่งอะตอมของกลุ่ม BH3 ไปเป็นวงโคจรว่างของกลุ่ม BH3 อีกกลุ่มหนึ่ง โบรานอื่นๆ ยังเป็นที่รู้จัก ซึ่งสามารถแสดงได้ด้วยสองแถว Bn Hn+4 และ Bn Hn+6
โบไรด์โลหะ S มีปฏิกิริยาและมักใช้ในการผลิตสารผสมโบเรนโดยการบำบัดด้วยกรด โบไรด์ของโลหะ d และ f ส่วนใหญ่ทนความร้อน แข็งมาก และมีความเสถียรทางเคมี มีการใช้กันอย่างแพร่หลายโดยตรงในรูปของโลหะผสมสำหรับการผลิตชิ้นส่วนเครื่องยนต์ไอพ่นและใบพัดกังหันก๊าซ โบไรด์บางชนิดใช้ทำแคโทดของอุปกรณ์อิเล็กทรอนิกส์
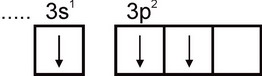
อลูมิเนียม. การกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมอะลูมิเนียมแสดงโดยสูตร 1s2 2s2 2p6 3s2 3p1 ชั้นอิเล็กตรอนชั้นนอกสุดของอะตอมมีอิเล็กตรอนที่ไม่มีการจับคู่หนึ่งตัว:
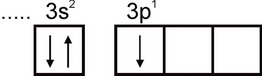
ดังนั้นอะลูมิเนียมจึงสามารถแสดงวาเลนซีเท่ากับหนึ่งได้ อย่างไรก็ตาม วาเลนซ์นี้ไม่ปกติสำหรับอะลูมิเนียม ในสารประกอบที่เสถียรทั้งหมด สถานะออกซิเดชันของอะลูมิเนียมคือ +3 วาเลนซีเท่ากับสามสอดคล้องกับสถานะตื่นเต้นของอะตอมอัล:
ในแง่ของความอุดมสมบูรณ์ อะลูมิเนียมอยู่ในอันดับที่ 4 ในบรรดาธาตุทั้งหมด (รองจาก O, H และ Si) และเป็นโลหะที่พบมากที่สุดในธรรมชาติ อะลูมิเนียมจำนวนมากมีความเข้มข้นในอะลูมิโนซิลิเกต: เฟลด์สปาร์ ไมกัส ฯลฯ
อะลูมิเนียม สีขาวเงิน น้ำหนักเบา และโลหะที่มีความเหนียวสูง โดยมีค่าการนำความร้อนและไฟฟ้าสูง
อลูมิเนียมมีฤทธิ์ทางเคมี โดยจะทำปฏิกิริยากับคลอรีนและโบรมีนที่อุณหภูมิห้อง และทำปฏิกิริยากับไอโอดีนเมื่อได้รับความร้อนหรือต่อหน้าน้ำเป็นตัวเร่งปฏิกิริยา ที่อุณหภูมิ 800 °C อลูมิเนียมจะทำปฏิกิริยากับไนโตรเจน และที่อุณหภูมิ 2000 °C กับคาร์บอน อะลูมิเนียมมีความสัมพันธ์ทางเคมีกับออกซิเจนสูง (ΔG0 298 = -1582 kJ/mol):
2Al + 0.502 = Al2 O3, ΔH0 298 = -1650 กิโลจูล/โมล
ในอากาศ อลูมิเนียมจะถูกเคลือบด้วยฟิล์มออกไซด์บางๆ ที่ทนทานมาก (10-8 ม.) ซึ่งทำให้ความแวววาวของโลหะของอะลูมิเนียมอ่อนลงบ้าง ด้วยฟิล์มออกไซด์ พื้นผิวอะลูมิเนียมจึงมีความต้านทานการกัดกร่อนสูง สิ่งนี้แสดงให้เห็นเป็นหลักในความไม่แยแสของอลูมิเนียมต่อน้ำและไอน้ำ เนื่องจากการก่อตัวของฟิล์มป้องกัน อลูมิเนียมจึงสามารถทนต่อกรดไนตริกและซัลฟิวริกเข้มข้นได้ กรดเหล่านี้ทำให้อลูมิเนียมผ่านความเย็น แนวโน้มที่จะเกิดฟิล์มทำให้สามารถเพิ่มความต้านทานการกัดกร่อนของอลูมิเนียมได้โดยการรักษาพื้นผิวด้วยสารออกซิไดซ์ที่แรง (เช่น K2 Cr2 O7) หรือใช้ออกซิเดชันขั้วบวก ในกรณีนี้ความหนาของฟิล์มออกไซด์จะเพิ่มขึ้นเป็น 3·10-5 ม อุณหภูมิสูงความแข็งแรงของฟิล์มกันรอยลดลงอย่างรวดเร็ว ถ้า ผลกระทบทางกลเมื่อเอาฟิล์มออกไซด์ออก อลูมิเนียมจะมีปฏิกิริยารุนแรงมาก มันทำปฏิกิริยาอย่างแรงกับน้ำและสารละลายที่เป็นกรดและด่าง แทนที่ไฮโดรเจนและก่อตัวเป็นแคตไอออนหรือแอนไอออน ปฏิกิริยาระหว่างอะลูมิเนียมกับสารละลายกรดจะเกิดขึ้นตามสมการของปฏิกิริยา
อัล + 6H2 O + 3H+ = [อัล(H2 O)6 ]3+ + 0.5H2
และด้วยสารละลายอัลคาไล
อัล + 3H2 O + OH- = [อัล(OH)4 ]- + 0.5H2
แคตไอออนและแอนไอออนของอะลูมิเนียมจะเปลี่ยนรูปเข้าหากันได้อย่างง่ายดายเมื่อค่า pH ของสารละลายเปลี่ยนไป:
[อัล(H2 O)6 ]3+ + 4OH- = [อัล(OH)4 ]- + 6H2 O
[อัล(OH)4 ]- + 4H+ + 2H2 O = [อัล(H2 O)6 ]3+
สารประกอบผสมยังสามารถเกิดเป็นสารละลายได้ เช่น [Al(H2 O)5 (OH)]2+ , [Al(H2 O)4 (OH)2 ]+ , [Al(H2 O)3 (OH)3 ] . อย่างหลังได้ง่าย (โดยเฉพาะเมื่อถูกความร้อน) จะทำให้ขาดน้ำและกลายเป็นไฮดรอกไซด์ Al(OH)3:
[อัล(H2 O)3 (OH)3 ] = อัล(OH)3 + 3H2 O
การใช้อะลูมิเนียมในเทคโนโลยีอย่างกว้างขวางที่สุดนั้นขึ้นอยู่กับคุณสมบัติทางกายภาพและคุณค่าของมัน คุณสมบัติทางเคมีและแพร่หลายไปในเปลือกโลก เนื่องจากมีค่าการนำไฟฟ้าสูง (4·10-5 โอห์ม-1 ซม.-1) และมีความหนาแน่นต่ำ จึงใช้สำหรับการผลิตสายไฟ อลูมิเนียมที่มีความเหนียวสูงทำให้สามารถสร้างฟอยล์ที่บางที่สุดได้ซึ่งใช้ในตัวเก็บประจุและแทนที่ตะกั่วในปลอกสายเคเบิลด้วยอลูมิเนียม เนื่องจากไม่เป็นแม่เหล็ก จึงมีการใช้อลูมิเนียมอัลลอยด์ในงานวิศวกรรมวิทยุ
อลูมิเนียมจำนวนมากใช้ในการผลิตโลหะผสมเบา: ดูราลูมิน (94% Al, Cu, Mg, Mn, Fe และ Si ที่เหลือ), ซิลูมิน (85 x 90% Al, 10 x 14% Si, Na ที่เหลือ) ฯลฯ . นอกจากนี้อลูมิเนียมยังใช้เป็นสารเติมแต่งอัลลอยด์เพื่อให้ต้านทานความร้อนได้ อลูมิเนียมและโลหะผสมครอบครองหนึ่งในสถานที่สำคัญในฐานะวัสดุโครงสร้างในการก่อสร้างเครื่องบิน จรวด วิศวกรรมเครื่องกล ฯลฯ ความต้านทานการกัดกร่อนของอลูมิเนียม (โดยเฉพาะการชุบอะโนไดซ์) มีมากกว่าความต้านทานการกัดกร่อนของเหล็กอย่างมีนัยสำคัญ ดังนั้นโลหะผสมจึงถูกใช้เป็นวัสดุโครงสร้างและการต่อเรือ ด้วยองค์ประกอบ d อลูมิเนียมจะเกิดสารประกอบทางเคมี - อินเตอร์เมทัลไลด์ (อลูมิไนด์): NiAl, Ni3 Al, CoAl ฯลฯ ซึ่งใช้เป็นวัสดุทนความร้อน อลูมิเนียมถูกนำมาใช้ในอะลูมิเนียมอุณหภูมิเพื่อผลิตโลหะหลายชนิดและสำหรับการเชื่อมโดยใช้วิธีเทอร์ไมต์ การบำบัดด้วยอะลูมิเนียมขึ้นอยู่กับความสัมพันธ์สูงของอะลูมิเนียมต่อออกซิเจน ตัวอย่างเช่น ในปฏิกิริยาที่เกิดขึ้นตามสมการ
8Al + 3Fe3 O4 = 4Al2 O3 + 9Fe
ความร้อนจะถูกปล่อยออกมาประมาณ 3,500 กิโลจูล และอุณหภูมิสูงถึง 3,000 องศาเซลเซียส
อะลูมิเนียมออกไซด์เป็นที่รู้จักในรูปแบบของการดัดแปลงหลายอย่าง เสถียรที่สุดคือα-Al2 O3 การดัดแปลงนี้พบในเปลือกโลกในรูปของคอรันดัมแร่ซึ่งใช้เตรียมแผ่นเจียรและผงกากกะรุน การใช้คอรันดัมเป็นวัสดุขัดถูขึ้นอยู่กับความแข็งสูง รองจากความแข็งของเพชร SiC คาร์บอรันดัม และ BN โบราโซนเท่านั้น เมื่อรวม Al2 O3 กับ Cr2 O3 จะได้ ทับทิมเทียม- พวกมันถูกใช้เพื่อสร้างหินรองรับในกลไกที่มีความแม่นยำ ใน เมื่อเร็วๆ นี้ทับทิมเทียมถูกนำมาใช้ในเครื่องกำเนิดควอนตัม (เลเซอร์) ผลิตภัณฑ์ที่ทำจาก Al2O3 ใช้เป็นวัสดุทนไฟและไดอิเล็กทริก
สารประกอบโพลีเมอร์อะลูมิเนียมไฮดรอกไซด์ Al(OH)3 มีโครงตาข่ายคริสตัลเป็นชั้นๆ แต่ละชั้นประกอบด้วย Al(OH)6 octahedra (รูปที่ 1) มีพันธะไฮโดรเจนระหว่างชั้นต่างๆ อะลูมิเนียมไฮดรอกไซด์ที่ได้จากปฏิกิริยาการแลกเปลี่ยนจะเป็นตะกอนสีขาวที่เป็นวุ้นซึ่งละลายได้สูงในกรดและด่าง เมื่อยืนนิ่ง ตะกอนจะ “มีอายุ” และสูญเสียกิจกรรมทางเคมีไป เมื่อเผาไฮดรอกไซด์จะสูญเสียน้ำและกลายเป็น Al2O3 ออกไซด์ อะลูมิเนียมเจลในรูปแบบหนึ่งของไฮดรอกไซด์อบแห้ง ถูกนำมาใช้ในเทคโนโลยีเป็นตัวดูดซับ
ซีโอไลต์สารประกอบอะลูมิเนียมที่เกี่ยวข้องกับอะลูมิโนซิลิเกตเป็นที่สนใจอย่างมาก องค์ประกอบสามารถแสดงได้ด้วยสูตรทั่วไป Meh Eu O2y ·nH2 O โดยที่ MeCa หรือ Na (น้อยกว่าปกติ Ba, Sr, K); E Si และ Al ในอัตราส่วนแปรผัน ผลึกซีโอไลต์มีช่องที่โมเลกุลของ H2O สามารถทะลุผ่านได้ ปริมาณน้ำในซีโอไลต์จะแตกต่างกันไปขึ้นอยู่กับความดันไอน้ำ ซีโอไลต์สามารถแลกเปลี่ยนน้ำที่มีอยู่กับของเหลวอื่นๆ (แอลกอฮอล์ ฯลฯ) ด้วยการให้ความร้อนอย่างอ่อนโยน น้ำจะค่อยๆ หลุดออกจากซีโอไลต์ แต่แม้แต่ภาวะขาดน้ำโดยสมบูรณ์ก็ไม่ได้นำไปสู่การทำลายผลึกซีโอไลต์ แคตไอออน Ca2+ หรือ Na+ ในซีโอไลต์ก่อให้เกิดชั้นการแพร่กระจาย พวกมันไม่ได้ถูกยึดไว้ในโครงตาข่ายคริสตัล แต่เมื่อรวมกับน้ำแล้วก็จะอยู่ในช่องว่างของคริสตัล ข้อมูลนี้อธิบายการมีอยู่ของคุณสมบัติการแลกเปลี่ยนแคตไอออนในซีโอไลต์ซึ่งมีความสำคัญสำหรับวัตถุประสงค์ทางเทคนิค ความสามารถในการแทนที่แคตไอออนบางตัวด้วยแคตไอออนอื่นทำให้สามารถใช้ซีโอไลต์เป็นตัวแลกเปลี่ยนไอออนได้
ซีโอไลต์เทียมจำนวนหนึ่งถูกใช้เป็นตะแกรงโมเลกุลที่เรียกว่าตะแกรงโมเลกุล ผลึกชนิดหลังมีลักษณะเป็นช่องแคบที่มีเส้นผ่านศูนย์กลางตั้งแต่ 3·10-10 ถึง 13·10-10 ม. ตะแกรงโมเลกุลจะดูดซับสารที่โมเลกุลสามารถเข้าไปในรูเหล่านี้ได้
ตัวอย่างเช่น ตะแกรงโมเลกุลที่มีเส้นผ่านศูนย์กลางรู 3.5 x 10-10 ม. สามารถดูดซับโมเลกุล H2, O2, N2 ได้ แต่ไม่ดูดซับโมเลกุล CH4 หรือ Ar ที่ใหญ่กว่า ด้วยการใช้ตะแกรงโมเลกุล คุณสามารถแยกไฮโดรคาร์บอน ก๊าซแห้ง ฯลฯ ได้
แกลเลียม อินเดียม และแทลเลียมในรูปของสารอย่างง่ายคือโลหะสีเงินขาวที่ละลายต่ำ คุณสมบัติทางกายภาพและเคมีของ Ga, In และ Tl แตกต่างอย่างเห็นได้ชัดจากคุณสมบัติของ Al แม้ว่าโครงสร้างทางอิเล็กทรอนิกส์ของระดับพลังงานภายนอกของอะตอมขององค์ประกอบที่พิจารณาจะมีความคล้ายคลึงกันก็ตาม
เห็นได้ชัดว่าเป็นเพราะความแตกต่างในโครงสร้างอิเล็กทรอนิกส์ของระดับพลังงานก่อนภายนอกของอะตอม Al: (n-1)s2 (n-1)p6 ในด้านหนึ่งและอะตอม Ga, In และ Tl อีกด้านหนึ่ง: ( n-1)s2 (n- 1)р6 (n-1)d10 .
สถานะออกซิเดชันของแกลเลียมและอินเดียมในสารประกอบเสถียรคือ +3 สถานะออกซิเดชันของ + 1 นั้นเป็นเรื่องปกติสำหรับสารประกอบแทลเลียม ซึ่งสถานะออกซิเดชันของโลหะคือ +3 ถือเป็นสารออกซิไดซ์ที่แรง
แกลเลียมมีช่วงอุณหภูมิที่กว้างของการดำรงอยู่ของสถานะของเหลว จุดหลอมเหลวต่ำ (ประมาณ 30 °C) และจุดเดือดสูง (2205 °C) ทำให้สามารถใช้แกลเลียมเหลวในการผลิตเกจวัดความดันได้
อินเดียมสะท้อนแสงคลื่นทุกความยาวคลื่นอย่างสม่ำเสมอ ดังนั้นจึงใช้เป็นเครื่องมือวัดที่แม่นยำสำหรับการผลิตกระจก นอกจากนี้ อินยังเป็นส่วนหนึ่งของโลหะผสมที่ละลายต่ำบางชนิดอีกด้วย
แทลเลียมยังถูกนำมาใช้ในโลหะผสมบางชนิด โดยส่วนใหญ่เป็นโลหะผสมที่มีดีบุกและตะกั่ว (ทนกรด, ตลับลูกปืน)
ออกไซด์ Ga2 O3, In2 O3 และ Tl2 O3 นั้นแทบไม่ละลายในน้ำ คุณสมบัติพื้นฐานที่เพิ่มขึ้นอย่างเห็นได้ชัดในซีรีย์ Ga2 O3 In2 O3 Tl2 O3 นั้นแสดงออกมาในความสามารถในการละลายที่เพิ่มขึ้นของออกไซด์ในกรด
ไฮดรอกไซด์ Ga(OH)3, In(OH)3, Tl(OH)3 จะไม่ละลายในน้ำเหมือนกับออกไซด์ ตะกอนสีขาวของ Ga(OH)3 ละลายได้ในกรดและด่างเท่าๆ กัน ส่วน Tl(OH)3 สีน้ำตาลแดงละลายได้ในกรดเท่านั้น
แกลเลียมและอินเดียมก่อให้เกิดสารประกอบไบนารีประเภท AIII BV โดยมีองค์ประกอบ p ของกลุ่ม V ของระบบธาตุ (เช่น GaP, GaAs, InSb เป็นต้น) ในสารประกอบประเภท AIII BV ส่วนใหญ่ ออร์บิทัลอิเล็กทรอนิกส์เป็นแบบผสม sp3; โครงผลึกของสารประกอบเหล่านี้มีโครงสร้างที่โดดเด่นด้วยการจัดเรียงพันธะเคมีแบบจัตุรมุข สารประกอบคล้ายเพชรหลายชนิดเหล่านี้เป็นสารกึ่งตัวนำ ใช้เป็นวัสดุสำหรับวงจรเรียงกระแสไฟ AC, เซ็นเซอร์, เครื่องกำเนิดเทอร์โมอิเล็กทริก ฯลฯ
คาร์บอน ซิลิคอน เจอร์เมเนียม ดีบุก และตะกั่ว เป็นกลุ่มย่อยหลักของกลุ่มที่ 4- ระดับพลังงานภายนอกขององค์ประกอบ p หมู่ IV ประกอบด้วยอิเล็กตรอน 4 ตัว (โครงแบบ ns2np2) โดยที่ 2 ตัวเป็นเอสอิเล็กตรอนที่จับคู่กัน และพีอิเล็กตรอนที่ไม่จับคู่อีก 2 ตัว
ในสภาวะไม่ตื่นเต้น องค์ประกอบของกลุ่มย่อยนี้แสดงวาเลนซีเป็นสอง เมื่อเปลี่ยนไปสู่สภาวะตื่นเต้น ร่วมกับการเปลี่ยนหนึ่งใน s-อิเล็กตรอนของระดับด้านนอกเป็นเซลล์อิสระของระดับย่อย p ในระดับเดียวกัน อิเล็กตรอนทั้งหมดของชั้นนอกจะกลายเป็น unpaired และความจุจะเพิ่มขึ้นเป็น 4.
ซัลเฟอร์ ซีลีเนียม เทลลูเรียม และพอโลเนียมก็มีเช่นกัน ระดับภายนอก 6 อิเล็กตรอน (s 2 หน้า 4 ) แต่พวกมันทั้งหมดมีระดับ d ที่ยังไม่สมบูรณ์ ดังนั้นพวกมันจึงสามารถมีอิเล็กตรอนที่ไม่จับคู่ได้มากถึง 6 ตัว และมีสถานะออกซิเดชันที่ -2, +4 และ +6 ในสารประกอบ
รูปแบบของการเปลี่ยนแปลงในกิจกรรมขององค์ประกอบเหล่านี้เหมือนกับในกลุ่มย่อยของฮาโลเจน: เทลลูไรด์จะถูกออกซิไดซ์ได้ง่ายที่สุด ตามด้วยเซเลไนด์และซัลไฟด์ สารประกอบออกซิเจนของซัลเฟอร์มีความเสถียรมากที่สุดคือสารประกอบซัลเฟอร์ (VI) และสำหรับสารประกอบเทลลูเรียม - เทลลูเรียม (IV) สารประกอบซีลีเนียมครองตำแหน่งกลาง
ในองค์ประกอบของกลุ่มย่อยโครเมียม ระดับ d จะถูกเติมเต็ม ดังนั้นที่ระดับ s ของอะตอมจะมีอิเล็กตรอน 1 ตัว (สำหรับโครเมียมและโมลิบดีนัม) หรือ 2 ตัว (สำหรับทังสเตน) สารทั้งหมดแสดงสถานะออกซิเดชันสูงสุดที่ +6 แต่โมลิบดีนัมและโดยเฉพาะโครเมียมนั้นมีลักษณะเฉพาะด้วยสารประกอบซึ่งมีสถานะออกซิเดชันต่ำกว่า (+4 สำหรับโมลิบดีนัมและ +3 หรือ +2 สำหรับโครเมียม) สารประกอบโครเมียม(III) มีความเสถียรมากและคล้ายกับสารประกอบอะลูมิเนียม
โลหะทั้งหมดของกลุ่มย่อยโครเมียมมีการใช้กันอย่างแพร่หลาย
โมลิบดีนัมได้รับครั้งแรกโดย K. V. Scheele ในปี พ.ศ. 2321 ใช้ในการผลิตเหล็กกล้าที่มีความแข็งแรงสูงและมีความเหนียวซึ่งใช้ในการผลิตกระบอกอาวุธ ชุดเกราะ เพลา ฯลฯ
เนื่องจากความสามารถในการระเหยที่อุณหภูมิสูงจึงไม่ค่อยมีประโยชน์ในการทำไส้หลอด แต่มีความสามารถในการหลอมรวมกับแก้วได้ดีจึงใช้ทำตัวยึดไส้หลอดทังสเตนในหลอดไส้
ทังสเตนถูกค้นพบโดย K.V. Scheele ในปี 1781 ซึ่งใช้ในการผลิตเหล็กกล้าชนิดพิเศษ การเติมทังสเตนลงในเหล็กจะเพิ่มความแข็ง ความยืดหยุ่น และความแข็งแรง เมื่อใช้ร่วมกับโครเมียม ทังสเตนจะทำให้เหล็กสามารถรักษาความแข็งที่อุณหภูมิสูงมากได้ ซึ่งเป็นเหตุผลว่าทำไมเหล็กดังกล่าวจึงถูกนำมาใช้ในการผลิตเครื่องตัดสำหรับเครื่องกลึงความเร็วสูง
ทังสเตนบริสุทธิ์มีจุดหลอมเหลวสูงที่สุดในบรรดาโลหะ (3370 องศาเซลเซียส) ดังนั้นจึงใช้ในการผลิตเส้นใยในหลอดไส้ ทังสเตนคาร์ไบด์มีความแข็งและทนความร้อนสูงมากและเป็นวัสดุหลัก ส่วนสำคัญโลหะผสมทนไฟ
กลุ่มย่อยไนโตรเจนประกอบด้วยห้าองค์ประกอบ: ไนโตรเจน, ฟอสฟอรัส, สารหนู, พลวงและบิสมัท สิ่งเหล่านี้คือองค์ประกอบ p ของกลุ่ม V ของระบบธาตุของ D. I. Mendeleevที่ระดับพลังงานภายนอก อะตอมของธาตุเหล่านี้ประกอบด้วยอิเล็กตรอน 5 ตัว ซึ่งมีโครงสร้างแบบ ns2np3 และมีการกระจายดังนี้
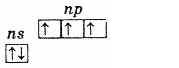
ดังนั้นสถานะออกซิเดชันสูงสุดขององค์ประกอบเหล่านี้คือ +5 ค่าต่ำสุดคือ -3 และ +3 ก็เป็นลักษณะเฉพาะเช่นกัน การมีอยู่ของอิเล็กตรอนที่ไม่ได้รับการจับคู่สามตัวที่ระดับด้านนอกบ่งชี้ว่าในสถานะที่ไม่ได้รับการกระตุ้น อะตอมขององค์ประกอบจะมีเวเลนซ์เป็น 3. ระดับด้านนอกของอะตอมไนโตรเจนประกอบด้วยระดับย่อย 2s และ 2p เพียงสองระดับเท่านั้น อะตอมขององค์ประกอบที่เหลือของกลุ่มย่อยนี้มีภายนอก ระดับพลังงานมีเซลล์ระดับย่อย d ว่าง ด้วยเหตุนี้ s-อิเล็กตรอนตัวใดตัวหนึ่งของระดับภายนอกสามารถเคลื่อนที่ไปยังระดับย่อย d ของระดับเดียวกันได้เมื่อมีการกระตุ้น ซึ่งนำไปสู่การก่อตัวของอิเล็กตรอน 5 ตัวที่ไม่ได้รับการจับคู่
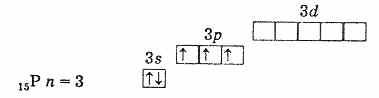
เปลือกอิเล็กตรอนชั้นนอกของฟอสฟอรัส (อะตอมที่ไม่ตื่นเต้น)
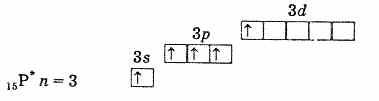
เปลือกอิเล็กตรอนชั้นนอกของอะตอมฟอสฟอรัสที่ถูกกระตุ้น ดังนั้น ฟอสฟอรัส สารหนู พลวง และบิสมัทในสถานะที่ตื่นเต้นจึงมีอิเล็กตรอนที่ไม่จับคู่ 5 ตัว และความจุของพวกมันในสถานะนี้คือ 5 กระตุ้นอิเล็กตรอนในอะตอมไนโตรเจน ในทำนองเดียวกันเป็นไปไม่ได้เนื่องจากไม่มีระดับย่อย d ในระดับที่สอง ดังนั้นไนโตรเจนจึงไม่สามารถเป็นเพนตะวาเลนต์ได้ แต่สามารถสร้างพันธะโควาเลนต์ที่สี่โดยกลไกผู้บริจาคและตัวรับเนื่องจากคู่อิเล็กตรอนเดี่ยว 2s2 กระบวนการอื่นก็เป็นไปได้สำหรับอะตอมไนโตรเจนเช่นกัน เมื่ออิเล็กตรอน 2 วินาทีตัวใดตัวหนึ่งถูกกำจัดออก ไนโตรเจนจะกลายเป็นไอออนเตตระวาเลนต์ที่มีประจุเพียงตัวเดียว N+

จากไนโตรเจนไปจนถึงบิสมัท รัศมีอะตอมจะเพิ่มขึ้น และศักยภาพในการแตกตัวเป็นไอออนลดลง คุณสมบัติรีดิวซ์ของอะตอมที่เป็นกลางจะเพิ่มขึ้นจาก N เป็น Bi และคุณสมบัติการออกซิไดซ์จะลดลง (ดูตารางที่ 21)
เมื่อไฮโดรเจน ไนโตรเจน ฟอสฟอรัส และสารหนูเกิดเป็นสารประกอบมีขั้ว RH3 ซึ่งมีสถานะออกซิเดชันเป็นลบที่ -3 โมเลกุล RH3 มีรูปร่างเสี้ยม ในสารประกอบเหล่านี้ พันธะของธาตุกับไฮโดรเจนจะแข็งแกร่งกว่าสารประกอบที่สอดคล้องกันของธาตุในกลุ่มย่อยของออกซิเจน และโดยเฉพาะอย่างยิ่งกลุ่มย่อยของฮาโลเจน ดังนั้นสารประกอบไฮโดรเจนขององค์ประกอบของกลุ่มย่อยไนโตรเจนในสารละลายที่เป็นน้ำจึงไม่ก่อให้เกิดไฮโดรเจนไอออน
ด้วยออกซิเจน องค์ประกอบของหมู่ย่อยไนโตรเจนจะเกิดออกไซด์ของสูตรทั่วไป R2O3 และ R2O5 ออกไซด์สอดคล้องกับกรด HRO2 และ HRO3 (และกรดออร์โธ H3RO4 ยกเว้นไนโตรเจน) ภายในกลุ่มย่อยธรรมชาติของออกไซด์จะเปลี่ยนแปลงดังนี้: กรดออกไซด์ N2O3; Р4О6 ออกไซด์ที่เป็นกรดอ่อน; As2O3 amphoteric ออกไซด์ที่มีคุณสมบัติเป็นกรดเด่น Sb2O3 amphoteric ออกไซด์ที่มีคุณสมบัติพื้นฐานเด่น ออกไซด์พื้นฐาน Bi2O3 ดังนั้นคุณสมบัติที่เป็นกรดของออกไซด์ขององค์ประกอบ R2O3 และ R2O5 จะลดลงเมื่อเลขอะตอมขององค์ประกอบเพิ่มขึ้น ดังที่เห็นได้จากตาราง 21 ภายในกลุ่มย่อยจากไนโตรเจนถึงบิสมัท คุณสมบัติอโลหะลดลงและคุณสมบัติของโลหะเพิ่มขึ้น ในพลวงคุณสมบัติเหล่านี้แสดงออกมาอย่างเท่าเทียมกันในบิสมัทคุณสมบัติทางโลหะมีอำนาจเหนือกว่าในไนโตรเจนคุณสมบัติทางอโลหะมีอำนาจเหนือกว่า ฟอสฟอรัส สารหนู และพลวงก่อให้เกิดสารประกอบอัลโลโทรปิกหลายชนิด
กลุ่มที่หกของตารางธาตุประกอบด้วยสองกลุ่มย่อย: กลุ่มหลัก - ออกซิเจน, ซัลเฟอร์, ซีลีเนียม, เทลลูเรียมและพอโลเนียม - และกลุ่มรอง - โครเมียม, โมลิบดีนัมและทังสเตน ในกลุ่มย่อยหลัก กลุ่มย่อยซีลีเนียมมีความโดดเด่น (ซีลีเนียม เทลลูเรียม และพอโลเนียม) กลุ่มย่อยรองเรียกว่ากลุ่มย่อยโครเมียม องค์ประกอบทั้งหมดของกลุ่มย่อยหลัก ยกเว้นออกซิเจน สามารถเพิ่มอิเล็กตรอนได้ 2 ตัว ทำให้เกิดไอออนลบ
องค์ประกอบของกลุ่มย่อยหลักมีอิเล็กตรอน 6 ตัว (s2p4) ในระดับอิเล็กทรอนิกส์ภายนอก อะตอมของออกซิเจนมีอิเล็กตรอนสองตัวที่ไม่จับคู่และไม่มีระดับ d ดังนั้น ออกซิเจนจึงแสดงสถานะออกซิเดชันเป็นส่วนใหญ่ (2 และเฉพาะในสารประกอบที่มีฟลูออรีน +2 เท่านั้น ซัลเฟอร์ ซีลีเนียม เทลลูเรียม และพอโลเนียมก็มีอิเล็กตรอน 6 ตัวในระดับภายนอก (s2p4) แต่พวกมันทั้งหมดมีระดับ d ที่ยังไม่เต็ม ดังนั้น พวกมันสามารถมีอิเล็กตรอนที่ไม่จับคู่ได้สูงสุดหกตัวและมีสถานะออกซิเดชันที่ 2, +4 และ +6 ในสารประกอบ
รูปแบบของการเปลี่ยนแปลงในกิจกรรมขององค์ประกอบเหล่านี้เหมือนกับในกลุ่มย่อยของฮาโลเจน: เทลลูไรด์จะถูกออกซิไดซ์ได้ง่ายที่สุด ตามด้วยเซเลไนด์และซัลไฟด์ ในบรรดาสารประกอบออกซิเจนของซัลเฟอร์ สารประกอบที่เสถียรที่สุดคือสารประกอบซัลเฟอร์ (VI) และสำหรับเทลลูเรียม สารประกอบเทลลูเรียม (IV) สารประกอบซีลีเนียมครองตำแหน่งกลาง
ซีลีเนียมและเทลลูเรียม รวมถึงสารประกอบของพวกมันกับโลหะบางชนิด (อินเดียม แทลเลียม ฯลฯ) มีคุณสมบัติเป็นเซมิคอนดักเตอร์และใช้กันอย่างแพร่หลายในอุปกรณ์อิเล็กทรอนิกส์ทางวิทยุ สารประกอบซีลีเนียมและเทลลูเรียมเป็นพิษมาก พวกมันถูกใช้ใน อุตสาหกรรมแก้วเพื่อผลิตแก้วสี (แดงและน้ำตาล)
ในองค์ประกอบของกลุ่มย่อยโครเมียม ระดับ d จะถูกเติมเต็ม ดังนั้นที่ระดับ s ของอะตอมจะมีอิเล็กตรอนหนึ่งตัว (สำหรับโครเมียมและโมลิบดีนัม) หรือสองตัว (สำหรับทังสเตน) สารทั้งหมดแสดงสถานะออกซิเดชันสูงสุดที่ +6 แต่โมลิบดีนัมและโดยเฉพาะโครเมียมนั้นมีลักษณะเฉพาะด้วยสารประกอบซึ่งมีสถานะออกซิเดชันต่ำกว่า (+4 สำหรับโมลิบดีนัมและ +3 หรือ +2 สำหรับโครเมียม) สารประกอบโครเมียม(III) มีความเสถียรมากและคล้ายกับสารประกอบอะลูมิเนียม โลหะทั้งหมดของกลุ่มย่อยโครเมียมมีการใช้กันอย่างแพร่หลาย
โมลิบดีนัมได้รับครั้งแรกโดย K.V. Scheele ในปี พ.ศ. 2321 ใช้ในการผลิตเหล็กกล้าที่มีความแข็งแรงสูงและมีความเหนียวซึ่งใช้ในการผลิตกระบอกอาวุธ ชุดเกราะ เพลา ฯลฯ เนื่องจากความสามารถในการระเหยที่อุณหภูมิสูง จึงมีความ ใช้ในการผลิตเส้นใยเพียงเล็กน้อย แต่มีความสามารถในการหลอมรวมกับแก้วได้ดีจึงใช้ทำที่ยึดไส้หลอดทังสเตนในหลอดไส้
ทังสเตนถูกค้นพบโดย K.V. Scheele ในปี 178! d มันถูกใช้ในการผลิตเหล็กพิเศษ การเติมทังสเตนลงในเหล็กจะเพิ่มความแข็ง ความยืดหยุ่น และความแข็งแรง เมื่อใช้ร่วมกับโครเมียม ทังสเตนจะทำให้เหล็กสามารถรักษาความแข็งที่อุณหภูมิสูงมากได้ ซึ่งเป็นเหตุผลว่าทำไมเหล็กดังกล่าวจึงถูกนำมาใช้ในการผลิตเครื่องตัดสำหรับเครื่องกลึงความเร็วสูง ทังสเตนบริสุทธิ์มีจุดหลอมเหลวสูงที่สุดในบรรดาโลหะ (3370 (C) ดังนั้นจึงใช้ในการผลิตเส้นใยในหลอดไส้ ทังสเตนคาร์ไบด์มีความแข็งมากและทนความร้อนได้และเป็นส่วนประกอบหลักของโลหะผสมทนไฟ
องค์ประกอบที่รวมอยู่ในกลุ่มที่ 7 ของตารางธาตุแบ่งออกเป็น 2 กลุ่มย่อย: กลุ่มหลัก - กลุ่มย่อยฮาโลเจน - และกลุ่มรอง - กลุ่มย่อยแมงกานีส- ไฮโดรเจนยังถูกจัดอยู่ในกลุ่มเดียวกัน แม้ว่าอะตอมของมันมีอิเล็กตรอนตัวเดียวที่ระดับเวเลนซ์ด้านนอก และควรอยู่ในกลุ่ม I
อย่างไรก็ตาม ไฮโดรเจนมีความเหมือนกันน้อยมากกับทั้งองค์ประกอบของกลุ่มย่อยหลัก ได้แก่ โลหะอัลคาไล และองค์ประกอบของกลุ่มย่อยรอง ได้แก่ ทองแดง เงิน และทอง ในเวลาเดียวกัน เช่นเดียวกับฮาโลเจน มันจะเพิ่มอิเล็กตรอนในการทำปฏิกิริยากับโลหะที่ใช้งานอยู่ และก่อให้เกิดไฮไดรด์ที่มีความคล้ายคลึงกับเฮไลด์
กลุ่มย่อยของฮาโลเจนประกอบด้วย ฟลูออรีน คลอรีน โบรมีน ไอโอดีน และแอสทาทีน องค์ประกอบ 4 ประการแรกพบได้ในธรรมชาติ ส่วนองค์ประกอบสุดท้ายได้มาจากการประดิษฐ์ ดังนั้นจึงมีการศึกษาน้อยกว่าฮาโลเจนอื่นๆ มาก คำว่า "ฮาโลเจน" หมายถึงการก่อตัวเป็นเกลือ องค์ประกอบของกลุ่มย่อยได้รับชื่อนี้เนื่องจากทำปฏิกิริยากับโลหะหลายชนิดได้ง่ายทำให้เกิดเกลือ
ฮาโลเจนทั้งหมดมีโครงสร้างเปลือกอิเล็กตรอนด้านนอก 2p5 - ดังนั้นพวกมันจึงรับอิเล็กตรอนได้ง่ายทำให้เกิดเปลือกอิเล็กตรอนก๊าซมีตระกูลที่เสถียร (s 2 ร 6 - ฟลูออรีนมีรัศมีอะตอมน้อยที่สุดในกลุ่มย่อย ส่วนส่วนที่เหลือจะเพิ่มขึ้นในชุด F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
ฮาโลเจน - องค์ประกอบที่กระตือรือร้นมาก พวกมันสามารถรับอิเล็กตรอนได้ไม่เพียงแต่จากอะตอมที่ปล่อยพวกมันได้ง่ายเท่านั้น แต่ยังมาจากไอออนและแม้กระทั่งแทนที่ฮาโลเจนอื่น ๆ ที่มีปฏิกิริยาน้อยกว่าจากสารประกอบของพวกมันด้วย ตัวอย่างเช่น ฟลูออรีนแทนที่คลอรีนจากคลอไรด์ โบรมีนจากโบรไมด์ และไอโอดีนจากไอโอไดด์
ในบรรดาฮาโลเจนทั้งหมด มีเพียงฟลูออรีนเท่านั้นซึ่งอยู่ในช่วง II เท่านั้นที่ไม่มีระดับ d ที่ยังไม่เติมเต็ม ด้วยเหตุนี้ จึงไม่สามารถมีอิเล็กตรอนที่ไม่จับคู่ได้มากกว่า 1 ตัว และจะมีความจุเพียง -1 เท่านั้น ในอะตอมของฮาโลเจนอื่นๆ ระดับ d จะไม่ถูกเติมเต็ม ซึ่งทำให้พวกมันมีจำนวนอิเล็กตรอนที่ไม่ตรงกันที่แตกต่างกัน และแสดงวาเลนซ์ -1, +1, +3, +5 และ +7 ที่พบในสารประกอบออกซิเจนของ คลอรีน โบรมีน และไอโอดีน
กลุ่มย่อยแมงกานีส ได้แก่ แมงกานีส เทคนีเชียม และรีเนียม องค์ประกอบของหมู่ย่อยแมงกานีสต่างจากฮาโลเจนตรงที่มีอิเล็กตรอนเพียง 2 ตัวในระดับอิเล็กทรอนิกส์ภายนอก ดังนั้นจึงไม่แสดงความสามารถในการเกาะติดอิเล็กตรอนจนกลายเป็นไอออนที่มีประจุลบ
แมงกานีสมีอยู่มากมายในธรรมชาติและมีการใช้กันอย่างแพร่หลายในอุตสาหกรรม
เทคนีเชียมเป็นกัมมันตรังสีไม่พบในธรรมชาติ แต่ได้มาจากการประดิษฐ์ (ครั้งแรกโดย E. Segre และ C. Perrier, 1937) องค์ประกอบนี้เกิดขึ้นเนื่องจากการสลายกัมมันตภาพรังสีของยูเรเนียม รีเนียมเป็นหนึ่งในธาตุ มันไม่ได้ก่อตัวเป็นแร่ธาตุอิสระ แต่พบว่าอยู่ร่วมกับแร่ธาตุบางชนิด โดยเฉพาะโมลิบดีนัม
มันถูกค้นพบโดย V. และ I. Noddak ในปี 1925 โลหะผสมที่มีการเติมรีเนียมเล็กน้อยจะช่วยเพิ่มความต้านทานต่อการกัดกร่อน การเติมรีเนียมลงในโลหะผสมจะเพิ่มความแข็งแรงเชิงกล
คุณสมบัติของรีเนียมนี้ทำให้สามารถใช้แทนได้ โลหะมีตระกูลอิริเดียม. เทอร์โมคัปเปิลแพลตตินัม-แพลตตินัม-รีเนียมทำงานได้ดีกว่าเทอร์โมคัปเปิลแพลตตินัม-แพลตตินัม-อิริเดียม แต่ไม่สามารถใช้ที่อุณหภูมิสูงมากได้เนื่องจากสารประกอบ Re ระเหยง่ายเกิดขึ้น 2 โอ 7 .
กลุ่มย่อยหลักของกลุ่มที่แปดของตารางธาตุประกอบด้วยก๊าซมีตระกูลฮีเลียม นีออน อาร์กอน คริปทอน ซีนอนและเรดอน องค์ประกอบเหล่านี้มีลักษณะเฉพาะด้วยกิจกรรมทางเคมีที่ต่ำมากซึ่งทำให้เกิดการเรียกพวกมันว่าก๊าซมีตระกูลหรือเฉื่อย พวกมันก่อตัวเป็นสารประกอบที่มีธาตุอื่นหรือสารอื่นที่มีความยากเท่านั้น ยังไม่ได้รับสารประกอบทางเคมีของฮีเลียม นีออน และอาร์กอน อะตอมของก๊าซมีตระกูลจะไม่รวมกันเป็นโมเลกุล กล่าวอีกนัยหนึ่ง โมเลกุลของพวกมันเป็นแบบโมโนอะตอม
ก๊าซมีตระกูลจะสิ้นสุดในแต่ละช่วงของระบบธาตุ ยกเว้นฮีเลียม พวกมันทั้งหมดมีอิเล็กตรอนแปดตัวในชั้นอิเล็กตรอนด้านนอกของอะตอม ก่อให้เกิดระบบที่เสถียรมาก เปลือกอิเล็กตรอนของฮีเลียมซึ่งประกอบด้วยอิเล็กตรอนสองตัวก็มีความเสถียรเช่นกัน ดังนั้นอะตอมของก๊าซมีตระกูลจึงมีลักษณะเฉพาะด้วยพลังงานไอออไนเซชันสูงและตามกฎแล้วพลังงานความสัมพันธ์ของอิเล็กตรอนเชิงลบ
เป็นเวลานานเชื่อกันว่าอะตอมของก๊าซมีตระกูลโดยทั่วไปไม่สามารถสร้างพันธะเคมีกับอะตอมของธาตุอื่นได้ มีเพียงสารประกอบโมเลกุลที่ค่อนข้างไม่เสถียรของก๊าซมีตระกูลเท่านั้นที่ทราบ เช่น ไฮเดรต
Ag-6N 2 0, Kg-6N 2 0, Xe-6N 2 0 ซึ่งเกิดขึ้นจากการกระทำของก๊าซมีตระกูลที่ถูกบีบอัดบนน้ำที่ตกผลึกด้วยความเย็นยิ่งยวด ไฮเดรตเหล่านี้เป็นของประเภทคลาเทรต พันธะวาเลนซ์จะไม่เกิดขึ้นระหว่างการก่อตัวของสารประกอบดังกล่าว การก่อตัวของคลาเทรตด้วยน้ำเป็นที่โปรดปรานจากการมีอยู่ของ โครงสร้างคริสตัลน้ำแข็งหลายช่อง
อย่างไรก็ตามในระหว่าง ทศวรรษที่ผ่านมาพบว่าคริปทอน ซีนอน และเรดอนสามารถรวมกับองค์ประกอบอื่นๆ และเหนือสิ่งอื่นใดคือมีฟลูออรีน ดังนั้น, ; ฟลูออไรด์ได้มาจากปฏิกิริยาโดยตรงของก๊าซมีตระกูลกับฟลูออรีน (โดยการให้ความร้อนหรือการปล่อยไฟฟ้า) KrF 2, XeF 2, KrF 4, XeF 4 และ RnF 4 - ทั้งหมดเป็นคริสตัลที่มีความเสถียรภายใต้สภาวะปกติ ได้รับอนุพันธ์ของซีนอนในสถานะออกซิเดชัน +6 เฮกซาฟลูออไรด์เอ็กซ์เอฟ 6 , XeO3 ไตรออกไซด์, Xe(OH)b ไฮดรอกไซด์ สารประกอบสองชนิดสุดท้ายมีคุณสมบัติเป็นกรด ดังนั้นเมื่อทำปฏิกิริยากับด่างจึงเกิดเกลือกรดซีโนนิก,ตัวอย่างเช่น: Xe0 3 + Ba(OH) 2 BaXe0 4 + H 2 0
อนุพันธ์; ซีนอน (VI) ตัวออกซิไดซ์ที่แรง อย่างไรก็ตาม เมื่อสัมผัสกับสารออกซิไดซ์ที่แรงกว่านั้น ก็เป็นไปได้ที่จะได้สารประกอบที่ซีนอนมีสถานะออกซิเดชันที่ -4-8 ในบรรดาสารประกอบเหล่านี้ รู้จักออคตาฟลูออไรด์ XeF 8, Xe0 4 เทตรอกไซด์ และออกโซเฮกซาฟลูออไรด์ซีโอเอฟ 6.
กิจกรรมทางเคมีที่สูงขึ้นของคริปทอน ซีนอน และเรดอนเมื่อเปรียบเทียบกับสมาชิกกลุ่มแรกของกลุ่มก๊าซมีตระกูลนั้นอธิบายได้จากศักยภาพในการแตกตัวเป็นไอออนของอะตอมที่ค่อนข้างต่ำ สำหรับคริปทอน ซีนอน และเรดอน ค่าเหล่านี้ใกล้เคียงกับศักย์ไอออไนเซชันขององค์ประกอบอื่นๆ บางส่วน (เช่น ศักย์ไอออไนเซชันของอะตอมไนโตรเจนคือ 14.53ใน, อะตอมของคลอรีน 12.97 V)
ยิ่งใหญ่ที่สุด การประยุกต์ใช้จริงพบอาร์กอน นีออน และฮีเลียม
ไฮโดรเจน (lat. ไฮโดรเจน)H องค์ประกอบทางเคมี อันดับแรกตามเลขอะตอมในตารางธาตุของเมนเดเลเยฟ มวลอะตอม 1.0079 ภายใต้สภาวะปกติ ไฮโดรเจนคือก๊าซ ไม่มีสี กลิ่น หรือรส
ข้อมูลทางประวัติศาสตร์ผลงานของนักเคมีในศตวรรษที่ 16 และ 17 กล่าวถึงการปล่อยก๊าซไวไฟซ้ำแล้วซ้ำอีกเมื่อกรดทำปฏิกิริยากับโลหะ ในปี ค.ศ. 1766 G. Cavendish รวบรวมและศึกษาก๊าซที่ปล่อยออกมา เรียกมันว่า "อากาศที่ติดไฟได้" คาเวนดิชเชื่อว่าก๊าซนี้เป็นฟโลกิสตันบริสุทธิ์ในฐานะผู้สนับสนุนทฤษฎีโฟลจิสตัน ในปี พ.ศ. 2326 A. Lavoisier ได้พิสูจน์ความซับซ้อนขององค์ประกอบของน้ำผ่านการวิเคราะห์และการสังเคราะห์น้ำ และในปี พ.ศ. 2330 เขาได้ระบุ "อากาศที่ติดไฟได้" เป็นองค์ประกอบทางเคมีใหม่ (ไฮโดรเจน) และมอบให้ ชื่อที่ทันสมัยไฮโดรเจน (จากภาษากรีก hydor - น้ำและ gennao - ฉันให้กำเนิด) ซึ่งแปลว่า "ให้กำเนิดน้ำ"; รากนี้ใช้ในชื่อของสารประกอบไฮโดรเจนและกระบวนการที่มีส่วนร่วม (เช่น ไฮไดรด์, ไฮโดรจิเนชัน) ชื่อรัสเซียสมัยใหม่ "ไฮโดรเจน" ถูกเสนอโดย M. F. Solovyov ในปี 1824
การแพร่กระจายของไฮโดรเจนในธรรมชาติไฮโดรเจนแพร่หลายในธรรมชาติ ปริมาณของมันในเปลือกโลก (เปลือกโลกและไฮโดรสเฟียร์) คือ 1% โดยมวลและ 16% โดยจำนวนอะตอม ไฮโดรเจนเป็นส่วนหนึ่งของสสารที่พบมากที่สุดในโลก - น้ำ (11.19% ของไฮโดรเจนโดยมวล) ในองค์ประกอบของสารประกอบที่ประกอบเป็นถ่านหิน, น้ำมัน, ก๊าซธรรมชาติ, ดินเหนียวตลอดจนสิ่งมีชีวิตของสัตว์และพืช (นั่นคือใน องค์ประกอบของโปรตีน กรดนิวคลีอิก ไขมัน คาร์โบไฮเดรต และอื่นๆ) ในรัฐอิสระ ไฮโดรเจนนั้นหายากมาก ปริมาณเล็กน้อยพบได้ในภูเขาไฟและก๊าซธรรมชาติอื่นๆ ไฮโดรเจนอิสระจำนวนเล็กน้อย (0.0001% โดยจำนวนอะตอม) มีอยู่ในชั้นบรรยากาศ ในอวกาศใกล้โลก ไฮโดรเจนในรูปของการไหลของโปรตอนจะก่อตัวเป็นแถบรังสีภายใน (“โปรตอน”) ของโลก ในอวกาศ ไฮโดรเจนเป็นองค์ประกอบที่มีมากที่สุด ในรูปของพลาสมา มีมวลประมาณครึ่งหนึ่งของดวงอาทิตย์และดาวฤกษ์ส่วนใหญ่ ซึ่งเป็นก๊าซส่วนใหญ่ของตัวกลางระหว่างดวงดาวและเนบิวลาก๊าซ ไฮโดรเจนมีอยู่ในชั้นบรรยากาศของดาวเคราะห์จำนวนหนึ่งและในดาวหางในรูปของ H อิสระ 2, มีเทน CH 4, แอมโมเนีย NH 3, น้ำ H 2 O อนุมูล เช่น CH, NH, OH, SiH, PH ฯลฯ ในรูปของการไหลของโปรตอน ไฮโดรเจนเป็นส่วนหนึ่งของการแผ่รังสีร่างกายของดวงอาทิตย์และ รังสีคอสมิก.
ไอโซโทป อะตอม และโมเลกุลของไฮโดรเจนไฮโดรเจนสามัญประกอบด้วยส่วนผสมของไอโซโทปเสถียร 2 ชนิด คือ ไฮโดรเจนเบา หรือโปรเทียม ( 1 H) และไฮโดรเจนหนักหรือดิวทีเรียม ( 2 H หรือ D) ในสารประกอบไฮโดรเจนตามธรรมชาติต่อ 1 อะตอม 2 H มีอะตอมเฉลี่ย 6800 อะตอม 1 H. ไอโซโทปกัมมันตภาพรังสีที่มีมวล 3 เรียกว่าไฮโดรเจนหนักยิ่งยวดหรือไอโซโทป ( 3 H หรือ T) โดยมีรังสี β แบบอ่อนและ T ครึ่งชีวิต½ = 12.262 ปี. ในธรรมชาติไอโซโทปจะเกิดขึ้นเช่นจากไนโตรเจนในบรรยากาศภายใต้อิทธิพลของนิวตรอนรังสีคอสมิก ในบรรยากาศนั้นไม่มีนัยสำคัญ (4 10-15 % ของจำนวนอะตอมไฮโดรเจนทั้งหมด) ได้รับไอโซโทปที่ไม่เสถียรอย่างยิ่ง 4 H. จำนวนมวลของไอโซโทป 1 นิวตัน, 2 นิวตัน, 3 นิวตัน และ 4 H, 1, 2, 3 และ 4 ตามลำดับบ่งชี้ว่านิวเคลียสของอะตอมโปรเทียมประกอบด้วยโปรตอนดิวทีเรียมเพียงตัวเดียว - โปรตอนและนิวตรอนหนึ่งตัว ทริเทียม - โปรตอนหนึ่งตัวและนิวตรอน 2 ตัว 4 H - หนึ่งโปรตอนและ 3 นิวตรอน ความแตกต่างอย่างมากในมวลของไอโซโทปไฮโดรเจนทำให้เกิดความแตกต่างที่เห็นได้ชัดเจนในคุณสมบัติทางกายภาพและทางเคมีมากกว่าในกรณีของไอโซโทปขององค์ประกอบอื่น
อะตอมไฮโดรเจนมีโครงสร้างที่ง่ายที่สุดในบรรดาอะตอมของธาตุอื่นๆ ทั้งหมด ประกอบด้วยนิวเคลียสและอิเล็กตรอนหนึ่งตัว พลังงานยึดเหนี่ยวของอิเล็กตรอนที่มีนิวเคลียส (ศักย์ไฟฟ้าไอออไนเซชัน) คือ 13.595 eV อะตอมไฮโดรเจนที่เป็นกลางยังสามารถเพิ่มอิเล็กตรอนตัวที่สองได้ ทำให้เกิดไอออนลบ H- ในกรณีนี้ พลังงานยึดเหนี่ยวของอิเล็กตรอนตัวที่สองที่มีอะตอมเป็นกลาง (สัมพรรคภาพอิเล็กตรอน) คือ 0.78 eV กลศาสตร์ควอนตัมช่วยให้เราคำนวณระดับพลังงานที่เป็นไปได้ทั้งหมดของอะตอมไฮโดรเจน ดังนั้นจึงให้การตีความสเปกตรัมอะตอมของมันได้อย่างสมบูรณ์ อะตอมไฮโดรเจนถูกใช้เป็นอะตอมแบบจำลองในการคำนวณเชิงกลควอนตัมของระดับพลังงานของอะตอมอื่นที่ซับซ้อนกว่า
โมเลกุลไฮโดรเจนเอช 2 ประกอบด้วยอะตอมสองอะตอมที่เชื่อมกันด้วยพันธะโควาเลนต์ พันธะเคมี- พลังงานของการแยกตัว (นั่นคือสลายตัวเป็นอะตอม) คือ 4.776 eV ระยะห่างระหว่างอะตอมที่ตำแหน่งสมดุลของนิวเคลียสคือ 0.7414 Å ที่อุณหภูมิสูง โมเลกุลไฮโดรเจนจะแยกตัวออกเป็นอะตอม (ระดับการแยกตัวที่ 2000°C คือ 0.0013 ที่ 5,000°C 0.95) อะตอมไฮโดรเจนยังเกิดขึ้นได้หลากหลาย ปฏิกิริยาเคมี(เช่น ผลของ Zn ต่อกรดไฮโดรคลอริก) อย่างไรก็ตามการมีอยู่ของไฮโดรเจนในสถานะอะตอมจะคงอยู่เท่านั้น เวลาอันสั้นอะตอมรวมตัวกันเป็นโมเลกุล H 2 .
คุณสมบัติทางกายภาพของไฮโดรเจนไฮโดรเจนเป็นสารที่เบาที่สุดในบรรดาสารทั้งหมดที่เรารู้จัก (เบากว่าอากาศ 14.4 เท่า) ความหนาแน่น 0.0899 กรัม/ลิตร ที่ 0°C และ 1 atm ไฮโดรเจนเดือด (เหลว) และละลาย (แข็งตัว) ตามลำดับ ที่อุณหภูมิ -252.8°C และ -259.1°C (เฉพาะฮีเลียมเท่านั้นที่มีมากกว่านั้น) อุณหภูมิต่ำละลายและเดือด) อุณหภูมิวิกฤตของไฮโดรเจนต่ำมาก (-240°C) ดังนั้นการทำให้กลายเป็นของเหลวจึงเต็มไปด้วยความยากลำบากอย่างมาก แรงดันวิกฤติ 12.8 กก.ฟ./ซม 2 (12.8 atm) ความหนาแน่นวิกฤติ 0.0312 กรัม/ซม 3 - ในบรรดาก๊าซทั้งหมด ไฮโดรเจนมีค่าการนำความร้อนสูงสุด เท่ากับ 0.174 W/(m K) ที่ 0°C และ 1 atm นั่นคือ 4.16 10-4 แคลอรี่/(s·cm·°С) ความจุความร้อนจำเพาะของไฮโดรเจนที่ 0°C และ 1 atm Cพี 14.208 kJ/(kg · K) ซึ่งก็คือ 3.394 cal/(g °C) ไฮโดรเจนละลายได้ในน้ำเล็กน้อย (0.0182 มล./กรัม ที่ 20°C และ 1 atm) แต่ละลายได้ดีในโลหะหลายชนิด (Ni, Pt, Pa และอื่นๆ) โดยเฉพาะในแพลเลเดียม (850 ปริมาตรต่อ 1 ปริมาตรของ Pd) ความสามารถในการละลายของไฮโดรเจนในโลหะสัมพันธ์กับความสามารถในการแพร่กระจายผ่านพวกมัน การแพร่กระจายผ่านโลหะผสมคาร์บอน (เช่น เหล็ก) บางครั้งอาจมาพร้อมกับการทำลายโลหะผสมเนื่องจากปฏิกิริยาของไฮโดรเจนกับคาร์บอน (ที่เรียกว่า การแยกคาร์บอน) ไฮโดรเจนเหลวมีน้ำหนักเบามาก (ความหนาแน่นที่ -253°C 0.0708 g/cm 3 ) และของไหล (ความหนืดที่ -253°C 13.8 สปอยซ์)
คุณสมบัติทางเคมีของไฮโดรเจนในสารประกอบส่วนใหญ่ ไฮโดรเจนมีวาเลนซ์ (หรือแม่นยำกว่านั้นคือสถานะออกซิเดชัน) +1 เช่น โซเดียมและโลหะอัลคาไลอื่นๆ โดยปกติจะถือว่าเป็นอะนาล็อกของโลหะเหล่านี้ ซึ่งเป็นกลุ่มหัวข้อที่ 1 ของระบบธาตุ อย่างไรก็ตาม ในโลหะไฮไดรด์ ไฮโดรเจนไอออนจะมีประจุลบ (สถานะออกซิเดชัน -1) ซึ่งก็คือ Na ไฮไดรด์+ฮ- สร้างเหมือนนาคลอไรด์+ เคลียร์ - - สิ่งนี้และข้อเท็จจริงอื่น ๆ (ความใกล้เคียง คุณสมบัติทางกายภาพไฮโดรเจนและฮาโลเจน ความสามารถของฮาโลเจนในการแทนที่ไฮโดรเจนในสารประกอบอินทรีย์) ทำให้มีเหตุผลในการจำแนกไฮโดรเจนให้อยู่ในกลุ่มที่ 7 ของตารางธาตุด้วย ภายใต้สภาวะปกติ โมเลกุลไฮโดรเจนจะมีฤทธิ์ค่อนข้างน้อย โดยจะรวมโดยตรงกับสารที่ไม่ใช่โลหะที่มีฤทธิ์มากที่สุดเท่านั้น (กับฟลูออรีน และในแสงที่มีคลอรีน) แต่เมื่อถูกความร้อนจะทำปฏิกิริยากับองค์ประกอบหลายอย่าง อะตอมไฮโดรเจนมีกิจกรรมทางเคมีเพิ่มขึ้นเมื่อเปรียบเทียบกับโมเลกุลไฮโดรเจน เมื่อออกซิเจน ไฮโดรเจนจะเกิดเป็นน้ำ:
เอช 2 + 1/2 โอ 2 = เอช 2 โอ
โดยมีการปล่อยความร้อน 285.937 kJ/mol ซึ่งก็คือ 68.3174 kcal/mol ของความร้อน (ที่ 25°C และ 1 atm) ที่ อุณหภูมิปกติปฏิกิริยาเกิดขึ้นช้ามาก สูงกว่า 550°C - เมื่อมีการระเบิด ขีดจำกัดการระเบิดของส่วนผสมไฮโดรเจน-ออกซิเจนคือ (โดยปริมาตร) ตั้งแต่ 4 ถึง 94% H 2 และส่วนผสมของไฮโดรเจนกับอากาศ - ตั้งแต่ 4 ถึง 74% H 2 (ผสม 2 เล่ม H 2 และ 1 เล่ม O 2 เรียกว่าแก๊สระเบิด) ไฮโดรเจนถูกใช้เพื่อลดปริมาณโลหะหลายชนิด เนื่องจากจะกำจัดออกซิเจนออกจากออกไซด์ของพวกมัน:
CuO + H 2 = Cu + H 2 O,
เฟ 3 O 4 + 4H 2 = 3เฟ + 4H 2 O เป็นต้น
เมื่อใช้ฮาโลเจน ไฮโดรเจนจะเกิดไฮโดรเจนเฮไลด์ ตัวอย่างเช่น
H 2 + Cl 2 = 2HCl
ในเวลาเดียวกัน ไฮโดรเจนจะระเบิดด้วยฟลูออรีน (แม้ในที่มืดและที่อุณหภูมิ - 252°C) ทำปฏิกิริยากับคลอรีนและโบรมีนเฉพาะเมื่อได้รับแสงสว่างหรือได้รับความร้อน และกับไอโอดีนเมื่อได้รับความร้อนเท่านั้น ไฮโดรเจนทำปฏิกิริยากับไนโตรเจนเพื่อสร้างแอมโมเนีย:
ZN 2 + N 2 = 2NH 3
เฉพาะตัวเร่งปฏิกิริยาและที่อุณหภูมิและความดันสูงเท่านั้น เมื่อถูกความร้อน ไฮโดรเจนจะทำปฏิกิริยาอย่างแรงกับซัลเฟอร์:
H 2 + S = H 2 S (ไฮโดรเจนซัลไฟด์)
ยากกว่ามากกับซีลีเนียมและเทลลูเรียม ไฮโดรเจนสามารถทำปฏิกิริยากับคาร์บอนบริสุทธิ์ได้โดยไม่ต้องใช้ตัวเร่งปฏิกิริยาที่อุณหภูมิสูงเท่านั้น:
2H 2 + C (อสัณฐาน) = C H 4 (มีเทน)
ไฮโดรเจนทำปฏิกิริยาโดยตรงกับโลหะบางชนิด (อัลคาไล อัลคาไลน์เอิร์ธ และอื่นๆ) ทำให้เกิดไฮไดรด์:
H 2 + 2Li = 2LiH
สิ่งที่สำคัญในทางปฏิบัติอย่างยิ่งคือปฏิกิริยาของไฮโดรเจนกับคาร์บอนมอนอกไซด์ (II) ซึ่งสารประกอบอินทรีย์ต่างๆ จะเกิดขึ้น ขึ้นอยู่กับอุณหภูมิ ความดัน และตัวเร่งปฏิกิริยา เช่น HCHO, CH 3 เขาและคนอื่นๆ ไฮโดรคาร์บอนไม่อิ่มตัวทำปฏิกิริยากับไฮโดรเจนจนอิ่มตัว เช่น
C n H 2n + H 2 = C n H 2n+2
บทบาทของไฮโดรเจนและสารประกอบในทางเคมีนั้นยอดเยี่ยมมาก ไฮโดรเจนเป็นตัวกำหนดคุณสมบัติที่เป็นกรดของกรดโปรติกที่เรียกว่า ไฮโดรเจนมีแนวโน้มที่จะก่อให้เกิดสิ่งที่เรียกว่าพันธะไฮโดรเจนกับองค์ประกอบบางอย่าง ซึ่งมีอิทธิพลชี้ขาดต่อคุณสมบัติของสารประกอบอินทรีย์และอนินทรีย์หลายชนิด
การได้รับไฮโดรเจนวัตถุดิบหลักประเภทสำหรับการผลิตไฮโดรเจนในภาคอุตสาหกรรม ได้แก่ ก๊าซไวไฟธรรมชาติ ก๊าซเตาอบโค้ก และก๊าซกลั่นน้ำมัน ไฮโดรเจนยังได้มาจากน้ำโดยอิเล็กโทรไลซิส (ในสถานที่ที่มีไฟฟ้าราคาถูก) วิธีที่สำคัญที่สุดในการผลิตไฮโดรเจนจากก๊าซธรรมชาติคือปฏิกิริยาระหว่างตัวเร่งปฏิกิริยาของไฮโดรคาร์บอน ซึ่งส่วนใหญ่เป็นก๊าซมีเทน กับไอน้ำ (การแปลงสภาพ):
CH 4 + H 2 O = CO + ZN 2
และการเกิดออกซิเดชันที่ไม่สมบูรณ์ของไฮโดรคาร์บอนกับออกซิเจน:
CH 4 + 1/2 O 2 = CO + 2H 2
คาร์บอนมอนอกไซด์ (II) ที่เกิดขึ้นยังได้รับการเปลี่ยนแปลงด้วย:
CO + H 2 O = CO 2 + H 2
ไฮโดรเจนที่ผลิตจากก๊าซธรรมชาติมีราคาถูกที่สุด
ไฮโดรเจนถูกแยกได้จากก๊าซเตาอบโค้กและก๊าซกลั่นน้ำมันโดยการนำส่วนประกอบที่เหลือของส่วนผสมก๊าซออก ซึ่งจะทำให้กลายเป็นของเหลวได้ง่ายกว่าไฮโดรเจนในระหว่างการทำความเย็นแบบลึก น้ำอิเล็กโทรไลซิสดำเนินการด้วยกระแสตรงโดยส่งผ่านสารละลาย KOH หรือ NaOH (ไม่ได้ใช้กรดเพื่อหลีกเลี่ยงการกัดกร่อนของอุปกรณ์เหล็ก) ในห้องปฏิบัติการ ไฮโดรเจนได้มาจากอิเล็กโทรไลซิสของน้ำ รวมถึงจากปฏิกิริยาระหว่างสังกะสีกับ กรดไฮโดรคลอริก- อย่างไรก็ตามมักใช้ไฮโดรเจนสำเร็จรูปในกระบอกสูบบ่อยขึ้น
การประยุกต์ใช้ไฮโดรเจนไฮโดรเจนเริ่มมีการผลิตในระดับอุตสาหกรรมเมื่อปลายศตวรรษที่ 18 เพื่อใช้ในการบรรจุ ลูกโป่ง- ปัจจุบันไฮโดรเจนถูกนำมาใช้อย่างแพร่หลายในอุตสาหกรรมเคมี โดยส่วนใหญ่ใช้ในการผลิตแอมโมเนีย ผู้บริโภครายใหญ่ของไฮโดรเจนคือการผลิตเมทิลและแอลกอฮอล์อื่นๆ น้ำมันเบนซินสังเคราะห์ และผลิตภัณฑ์อื่นๆ ที่ได้จากการสังเคราะห์จากไฮโดรเจนและคาร์บอนมอนอกไซด์ (II) ไฮโดรเจนใช้สำหรับการเติมไฮโดรเจนของเชื้อเพลิงแข็งและของเหลวหนัก ไขมัน และอื่นๆ สำหรับการสังเคราะห์ HCl สำหรับการบำบัดด้วยไฮโดรทรีตของผลิตภัณฑ์ปิโตรเลียม ในการเชื่อมและตัดโลหะด้วยเปลวไฟออกซิเจน-ไฮโดรเจน (อุณหภูมิสูงถึง 2,800°C) และในการเชื่อมอะตอมไฮโดรเจน (สูงถึง 4000°C) ไอโซโทปไฮโดรเจน - ดิวทีเรียมและทริเทียม - พบการใช้งานที่สำคัญมากในพลังงานนิวเคลียร์
คุณสมบัติทางเคมีของธาตุหน้า 13
เคมีเป็นวิทยาศาสตร์ที่ศึกษาองค์ประกอบทางเคมี สารเชิงเดี่ยวและซับซ้อนที่พวกมันก่อตัว (องค์ประกอบ โครงสร้าง คุณสมบัติ) การเปลี่ยนแปลงของพวกมัน และกฎเกณฑ์ที่การเปลี่ยนแปลงเหล่านี้ปฏิบัติตาม แบ่งออกเป็นอนินทรีย์อินทรีย์กายภาพวิเคราะห์คอลลอยด์ ฯลฯ เคมีสมัยใหม่เชื่อมโยงกับวิทยาศาสตร์อื่น ๆ ซึ่งเป็นผลมาจากพื้นที่ชายแดนของวิทยาศาสตร์เกิดขึ้น: ชีวเคมี, เคมีเกษตร, คอสโมเคมี, เคมีรังสี ฯลฯ ความสำเร็จของเคมีสมัยใหม่ เป็นสิ่งกระตุ้น การเติบโตอย่างเข้มข้นอุตสาหกรรมเคมี การเล่น บทบาทที่สำคัญในความก้าวหน้าทางวิทยาศาสตร์และเทคโนโลยีของทุกอุตสาหกรรม เศรษฐกิจของประเทศ- เคมีมีบทบาทสำคัญในการแก้ปัญหาที่เร่งด่วนและมีแนวโน้มมากที่สุด สังคมสมัยใหม่(การเพิ่มประสิทธิภาพและความปลอดภัยของปุ๋ยเทียมเพื่อเพิ่มผลผลิตทางการเกษตรและปัญหาการสังเคราะห์ผลิตภัณฑ์อาหารจากวัตถุดิบที่ไม่ใช่อาหาร การพัฒนาแหล่งวัตถุดิบในมหาสมุทร การพัฒนาและการสร้างแหล่งพลังงานใหม่ การสังเคราะห์แหล่งพลังงานใหม่ สารและองค์ประกอบที่จำเป็นในการแก้ปัญหาในอนาคต สิ่งแวดล้อม- ดูหมายเลข 2 หน้า 334
วัตถุประสงค์ของการศึกษาทางเคมีคือองค์ประกอบทางเคมีและสารประกอบของพวกมัน องค์ประกอบทางเคมีคือกลุ่มของอะตอมที่มี ค่าใช้จ่ายเท่ากันแกน ในทางกลับกัน อะตอมก็คืออนุภาคที่เล็กที่สุดขององค์ประกอบทางเคมีที่ยังคงคุณสมบัติทางเคมีไว้ทั้งหมด ดังนั้นองค์ประกอบทางเคมีแต่ละองค์ประกอบจึงสอดคล้องกับอะตอมบางประเภท ดูข้อ 3, หน้า 11.
โมเลกุลเป็นอนุภาคที่เล็กที่สุดของสารแต่ละตัวที่สามารถดำรงอยู่ได้โดยอิสระ โดยมีคุณสมบัติทางเคมีพื้นฐานและประกอบด้วยอะตอมที่เหมือนกันหรือต่างกัน โมเลกุลอาจเป็นแบบหนึ่ง สอง หรือหลายอะตอมก็ได้ พวกมันเป็นอนุภาคที่เป็นส่วนประกอบของสสาร หากโมเลกุลประกอบด้วยอะตอมที่เหมือนกัน สารนั้นจะถูกเรียกว่าเชิงเดี่ยวหรือเชิงประถมศึกษา เช่น He, Ar, H2, O2, O3, S4, P4 สารเชิงเดี่ยวเป็นรูปแบบหนึ่งของการดำรงอยู่ขององค์ประกอบทางเคมีในสถานะอิสระ ดูข้อ 3 หน้า 11 หน้า 12
ถ้าโมเลกุลของสารประกอบด้วยอะตอมที่แตกต่างกัน สารนั้นจะถูกเรียกว่าสารเชิงซ้อน (หรือสารประกอบทางเคมี) เช่น CO, H2O, NH3, H3PO4 สารใดๆ มีลักษณะเฉพาะด้วยองค์ประกอบบางอย่าง (ธรรมชาติและจำนวนอะตอมในโมเลกุลของมัน) โครงสร้าง (การจัดเรียงเชิงพื้นที่ของอะตอมในโมเลกุล) และคุณสมบัติทางกายภาพและเคมีบางอย่าง ดูข้อ 3, หน้า 12.
คุณสมบัติทางเคมีของสารบ่งบอกถึงความสามารถในการมีส่วนร่วมในปฏิกิริยาเคมีนั่นคือในกระบวนการเปลี่ยนสารบางชนิดให้เป็นสารอื่น เพื่อให้เข้าใจคุณสมบัติเหล่านี้ จำเป็นต้องทราบองค์ประกอบและโครงสร้างของสาร ดูข้อ 3, หน้า 12.
ตารางธาตุทั้งหมดสามารถแบ่งออกเป็นโลหะ อโลหะ และสารแอมโฟเทอริก โลหะ- สารง่าย ๆ โดดเด่นด้วยความสามารถในการบริจาคอิเล็กตรอนซึ่งอยู่ที่ระดับพลังงานภายนอก (วาเลนซ์อิเล็กตรอน) และเปลี่ยนเป็นไอออนที่มีประจุบวก โลหะเกือบทั้งหมดมีค่าการนำไฟฟ้าและความร้อนสูง มีความสามารถในการสะท้อนแสงคลื่นได้ดี (ซึ่งเป็นตัวกำหนดความแวววาวและความทึบของแสง) และความเป็นพลาสติก ในสถานะของแข็งมักมีโครงสร้างผลึก การเชื่อมต่อระหว่างอะตอมในโลหะนั้นดำเนินการโดยเวเลนซ์อิเล็กตรอน ซึ่งเคลื่อนที่อย่างอิสระในโครงตาข่ายคริสตัลที่เกิดจากไอออนของโลหะที่มีประจุบวก จากธาตุ 107 ธาตุในตารางธาตุ มี 83 ธาตุที่เป็นโลหะ คุณสมบัติด้านสมรรถนะหลายประการของโลหะไม่เพียงแต่ขึ้นอยู่กับคุณสมบัติทางเคมีเท่านั้น แต่ยังขึ้นอยู่กับโครงสร้างที่ได้รับจากวิธีการผลิตและการแปรรูปในภายหลังด้วย สิ่งนี้สร้างโอกาสในการเปลี่ยนแปลงคุณสมบัติของโลหะอย่างกว้างขวาง และทำให้เป็นวัสดุโครงสร้าง ไฟฟ้า เครื่องกล และวัสดุอื่นๆ ที่สำคัญที่สุด ปัจจุบันโลหะมีการใช้กันอย่างแพร่หลายในเทคโนโลยีด้านต่างๆ อโลหะ- สารธรรมดาที่ไม่อ่อนตัว เงางามเป็นโลหะ, เป็นตัวนำความร้อนและไฟฟ้าที่ไม่ดี อะตอมที่ไม่ใช่โลหะมีลักษณะเด่นคือความสามารถในการยึดเกาะอิเล็กตรอน เช่น กลายเป็นไอออนที่มีประจุลบ อโลหะประกอบด้วย 22 ธาตุ: H, B, C, Si, N, P, As, O, S, Se, Te, ฮาโลเจน และก๊าซมีตระกูล ออกไซด์ของอโลหะมีลักษณะเป็นกรดซึ่งสอดคล้องกับกรดที่มีออกซิเจน สารแอมโฟเทอริก- สารที่มีแนวโน้มว่าจะมีคุณสมบัติทั้งเป็นกรดและเบส ตัวอย่างเช่น สารแอมโฟเทอริกที่ทำปฏิกิริยากับเบสแก่สามารถแสดงคุณสมบัติที่เป็นกรดได้ ขณะเดียวกัน สารชนิดเดียวกันที่ทำปฏิกิริยากับกรดแก่ก็สามารถแสดงคุณสมบัติพื้นฐานได้ ดูหมายเลข 2, หน้า 273, หน้า 279, หน้า 225
พิจารณาตารางธาตุขององค์ประกอบทางเคมี มันถูกสร้างขึ้นบนพื้นฐานของกฎหมายเป็นระยะ ตารางประกอบด้วย 7 คาบ 8 กลุ่ม
ระยะเวลาเป็นแถวแนวนอนของตาราง โดยแบ่งออกเป็นขนาดใหญ่และเล็ก ในยุคสบู่มี 2 ธาตุ (ช่วงที่ 1) หรือ 8 ธาตุ (ช่วงที่ 2 และ 3) ในช่วงใหญ่มี 18 ธาตุ (ช่วงที่ 4 และ 5) หรือ 32 ธาตุ (ช่วงที่ 6) ช่วงที่ 7 ยังไม่สิ้นสุด ช่วงเวลาใดๆ ก็ตามจะเริ่มต้นด้วยโลหะทั่วไปและสิ้นสุดด้วยโลหะที่ไม่ใช่โลหะและก๊าซมีตระกูลทั่วไป ดูหมายเลข 1 หน้า 271
คอลัมน์แนวตั้งเรียกว่ากลุ่มขององค์ประกอบ แต่ละกลุ่มแบ่งออกเป็นสองกลุ่มย่อย: หลักและรอง กลุ่มย่อยคือกลุ่มขององค์ประกอบที่เป็นอะนาลอกทางเคมี มักจะมีองค์ประกอบของกลุ่มย่อย ระดับสูงสุดออกซิเดชันที่สอดคล้องกับหมายเลขกลุ่ม ดูหมายเลข 1 หน้า 271
ในกลุ่มย่อยหลัก คุณสมบัติทางเคมีขององค์ประกอบอาจแตกต่างกันอย่างมาก
"เคมี ม.9" ส.ส. กาเบรียลยัน (GDZ)
ลักษณะขององค์ประกอบทางเคมี กฎหมายเป็นระยะของ Mendeleev
คำถามที่ 1.
กฎธาตุของเมนเดเลเยฟเป็นหนึ่งในกฎพื้นฐานของเคมี ก็สามารถโต้แย้งได้ว่า เคมีสมัยใหม่สร้างขึ้นบนนั้น เขาอธิบายการพึ่งพาคุณสมบัติของอะตอมในโครงสร้างของพวกมัน สรุปการพึ่งพาองค์ประกอบทั้งหมดนี้โดยแบ่งออกเป็นกลุ่มต่างๆ และยังทำนายคุณสมบัติของพวกมันขึ้นอยู่กับโครงสร้างและโครงสร้างโดยขึ้นอยู่กับคุณสมบัติ
มีกฎหมายอื่นๆ ที่มีหน้าที่อธิบาย อธิบาย และคาดการณ์ ตัวอย่างเช่น กฎการอนุรักษ์พลังงาน กฎการหักเหของแสง กฎพันธุกรรมของเมนเดล กฎ แรงโน้มถ่วงสากลฯลฯ
คำถามที่ 2.
ตามตารางธาตุเราจะพบองค์ประกอบที่มีการจัดเรียงอิเล็กตรอนตามที่ต้องการในระดับพลังงาน (2 และ 5) องค์ประกอบนี้คือไนโตรเจน: N: 1s 2 2s 2 2p 3
องค์ประกอบนี้ก่อให้เกิดสารอย่างง่าย - N 2 ไนโตรเจน สารประกอบไฮโดรเจนของไนโตรเจน - NH 3, แอมโมเนีย ไนตริกออกไซด์สูงสุดคือ N2O5 ออกไซด์นี้เป็นของออกไซด์ที่เป็นกรดเพราะเมื่อละลายในน้ำจะเข้มข้น กรดไนตริก HNO3.
ไม่มี 2 O 5 + H 2 O = 2HNO 3;
N 2 O 5 + BaO = Ba(OH) 2;
N 2 O 5 + Ba(OH) 2 = Ba(NO 3) 2 + H 2 O;
ไนโตรเจนในสถานะออกซิเดชัน +5 (N +5) มีคุณสมบัติออกซิไดซ์ที่แรง:
2N 2 O 5 + 5C = 2N 2 + 5CO 2
คำถามที่ 3.
ก่อนหน้านี้ธาตุเบริลเลียมมีสาเหตุมาจากความผิดพลาด กลุ่มที่สาม- เหตุผลนี้คือการกำหนดมวลอะตอมของเบริลเลียมไม่ถูกต้อง (แทนที่จะเป็น 9 ถือว่าเท่ากับ 13.5) ดิ. Mendeleev แนะนำว่าเบริลเลียมอยู่ในกลุ่ม II โดยพิจารณาจากคุณสมบัติทางเคมีของธาตุ คุณสมบัติของเบริลเลียมมีความคล้ายคลึงกับแมกนีเซียม (Mg) และแคลเซียม (Ca) มาก และแตกต่างอย่างสิ้นเชิงจากคุณสมบัติของอะลูมิเนียม (Al) เมื่อรู้ว่ามวลอะตอมของ Li และ B ซึ่งเป็นองค์ประกอบข้างเคียงของ Be เท่ากับ 7 และ 11 ตามลำดับ D.I. Mendeleev จึงสันนิษฐานว่ามวลอะตอมของเบริลเลียมคือ 9
คำถามที่ 4.
Ca คืออะตอมที่มีการกระจายอิเล็กตรอนตามอนุกรม
หมายเลข 2, 8, 8, 2
องค์ประกอบหมายเลข 7-N
องค์ประกอบหมายเลข 8 - อ.
สมการปฏิกิริยา:
3Ca + N 2 = Ca 3 N 2
2Ca + O 2 = 2CaO
ผลิตภัณฑ์ที่ทำปฏิกิริยามีประเภทพันธะไอออนิก
ไนโตรเจนและออกซิเจนมีโครงสร้างโมเลกุล โปรยคริสตัลและแคลเซียมก็มีโครงตาข่ายโลหะ
ผลิตภัณฑ์ปฏิสัมพันธ์ - Ca 3 N 2 และ CaO - มีโครงสร้างตาข่ายคริสตัลไอออนิก
คำถามที่ 5.
N, P, As, Sb, Bi – เสริมสร้างคุณสมบัติของโลหะ
คุณสมบัติทางโลหะของกลุ่มได้รับการปรับปรุงให้ดีขึ้น
คำถามที่ 6.
ในชุดองค์ประกอบ: N, Mg, Al, Si, P, S, Cl - การเสริมสร้างคุณสมบัติที่ไม่ใช่โลหะ
คุณสมบัติที่ไม่ใช่โลหะของธาตุจะเพิ่มขึ้นตามคาบ
คำถามที่ 7.
Cl 2 O 7, P 2 O 5, SiO 2, Al 2 O 3, MgO, Na 2 O - ลดคุณสมบัติของกรด
คุณสมบัติของกรดจะเพิ่มขึ้นในช่วงเวลาหนึ่ง
HClO 4, H3PO 4, H 2 SO 4, Al (OH) 3, NaOH – ลดคุณสมบัติของกรด
คำถามที่ 8.
B 2 O 3 , BeO, Li 2 O – เพิ่มคุณสมบัติพื้นฐาน
B(OH) 3, Be(OH) 2, LiOH - เพิ่มคุณสมบัติพื้นฐาน
B(OH) 3 – กรดอ่อน;
เป็น(OH) 2 - ฐานอ่อนแอ;
LiOH เป็นฐานที่แข็งแกร่ง
คำถามที่ 9.
ตารางธาตุสะท้อนความสัมพันธ์ขององค์ประกอบทางเคมี เลขอะตอมขององค์ประกอบเท่ากับประจุของนิวเคลียส และในเชิงตัวเลขจะเท่ากับจำนวนโปรตอน จำนวนนิวตรอนที่มีอยู่ในนิวเคลียสขององค์ประกอบหนึ่งสามารถแตกต่างกันได้ซึ่งตรงกันข้ามกับจำนวนโปรตอน อะตอมของธาตุหนึ่งซึ่งมีนิวเคลียสประกอบด้วย หมายเลขที่แตกต่างกันนิวตรอนเรียกว่าไอโซโทป
องค์ประกอบทางเคมีแต่ละองค์ประกอบมีไอโซโทปหลายชนิด (ได้มาจากธรรมชาติหรือได้มาจากการประดิษฐ์) มวลอะตอมขององค์ประกอบทางเคมีเท่ากับค่าเฉลี่ยของมวลของไอโซโทปธรรมชาติทั้งหมดโดยคำนึงถึงความอุดมสมบูรณ์ของพวกมัน
ด้วยการค้นพบไอโซโทป ประจุของนิวเคลียสจึงเริ่มถูกนำมาใช้เพื่อกระจายธาตุไปตามตารางธาตุแทนมวลอะตอม
คำถามที่ 10.
สิ่งนี้เกิดขึ้นเนื่องจากคุณสมบัติของธาตุและสารประกอบไม่ได้ขึ้นอยู่กับจำนวนอิเล็กตรอนทั้งหมด แต่ขึ้นอยู่กับจำนวนเวเลนซ์อิเล็กตรอนที่อยู่ในชั้นสุดท้ายเท่านั้น จำนวนเวเลนซ์อิเล็กตรอนเปลี่ยนแปลงเป็นระยะ ดังนั้นคุณสมบัติขององค์ประกอบจึงเปลี่ยนแปลงเป็นระยะเช่นกัน
คำถามที่ 11.
1. คุณสมบัติขององค์ประกอบทางเคมีและสารที่เกิดขึ้นนั้นจะขึ้นอยู่กับมวลอะตอมสัมพัทธ์ขององค์ประกอบเป็นระยะ
2. คุณสมบัติขององค์ประกอบทางเคมีและสารที่เกิดขึ้นนั้นขึ้นอยู่กับประจุของนิวเคลียสอะตอมขององค์ประกอบเป็นระยะ ๆ














