Mavzu: Elementlarning kimyoviy xossalari.
Reja:
1. Metallar va ularning birikmalarining xossalari ( I va II boblar subgr.)
1.1 IA elementlari
1.2 IIA elementlari umumiy xususiyatlarni guruhlaydi.
2. Elementlarning kimyoviy xossalari.
2.1 IIIA elementlari umumiy xususiyatlarni guruhlaydi.
2.2 IVA elementlari umumiy xususiyatlarni guruhlaydi.
2.3 VA elementlari umumiy xususiyatlarni guruhlaydi.
2.4 VIA elementlari umumiy xususiyatlarni guruhlaydi.
2.5 VIIA elementlari umumiy xususiyatlarni guruhlaydi.
2.6 VIIIA elementlari umumiy xususiyatlarni guruhlaydi.
3.Vodorod
D. I. Mendeleyev kimyoviy elementlar davriy sistemasining I guruhining asosiy kichik guruhi ishqoriy metallar elementlari: litiy Li, natriy Na, kaliy K, rubidiy Rb, seziy Cs va fransiy Fr. Bu metallar gidroksidi metallar deb ataladi, chunki ularning birikmalarining aksariyati suvda eriydi. Slavyan tilida "lich" "eritish" degan ma'noni anglatadi, bu metallar guruhining nomini aniqladi. Ishqoriy metallar suvda eritilganda ishqor deb ataladigan eruvchan gidroksidlar hosil bo'ladi. G. Davy birinchi bo'lib 1807 yilda erkin kaliy va natriyni oldi.
Tashqi elektron qatlamda ishqoriy metall atomlarining har birida bittadan elektron mavjud. Ikkinchi tashqi elektron qatlamda litiy atomi ikkita elektronni o'z ichiga oladi, qolgan ishqoriy metallarning atomlarida esa sakkizta elektron mavjud. Yadrodan nisbatan katta masofada joylashgan tashqi elektron qatlamida faqat bitta elektronga ega bo'lgan bu elementlarning atomlari bu elektrondan juda oson voz kechadi, ya'ni ular past ionlanish energiyasi bilan ajralib turadi. Bu holda hosil bo'lgan yagona zaryadlangan musbat ionlar mos keladigan nobel gazning barqaror elektron tuzilishiga ega (geliy atomining litiy ion tuzilishi, natriy ioni neon atomi va boshqalar). Tashqi elektronlardan voz kechish qulayligi ko'rib chiqilayotgan elementlarni metallarning eng tipik vakillari sifatida tavsiflaydi: metall xususiyatlar ayniqsa gidroksidi metallarda namoyon bo'ladi.
Litiydan tashqari barcha gidroksidi metallar atomlarining nafaqat tashqi, balki oxirgidan oldingi elektron qatlamining bir xil tuzilishi ushbu elementlarning xususiyatlarining katta o'xshashligini belgilaydi. Shu bilan birga, kichik guruh bo'ylab yuqoridan pastga siljishda yadro zaryadining va atomdagi elektronlarning umumiy sonining ortishi ularning xossalarida ba'zi farqlarni keltirib chiqaradi. Boshqa guruhlarda bo'lgani kabi, bu farqlar, asosan, valentlik elektronlarini berish qulayligining oshishi va atom sonining ortishi bilan metall xususiyatlarning oshishi bilan namoyon bo'ladi.
|
Ishqoriy metallarning xossalari |
||||||||
|
Atom |
ism, |
Metall |
Ionik |
Potentsial |
EO |
p, |
tpl, |
t kip, |
|
Lityum Li |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
Natriy Na |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
Kaliy K |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
Rubidiy Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
Seziy Cs |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
Ishqoriy metallarning kimyoviy xossalari. Ishqoriy metallarning suv, kislorod va azotga nisbatan yuqori kimyoviy faolligi tufayli ular kerosin qatlami ostida saqlanadi. Ishqoriy metall, parcha bilan reaksiyani amalga oshirish uchun to'g'ri o'lcham kerosin qatlami ostida ehtiyotkorlik bilan skalpel bilan kesiladi, argon atmosferasida metall yuzasi havo bilan o'zaro ta'sir qilish mahsulotlaridan yaxshilab tozalanadi va shundan keyingina namuna reaksiya idishiga joylashtiriladi.
1. Suv bilan o'zaro ta'siri. Ishqoriy metallarning muhim xossasiular yuqori faollik suvga nisbatan. Litiy suv bilan eng tinch (portlashsiz) reaksiyaga kirishadi:
Shunga o'xshash reaktsiya amalga oshirilganda, natriy sariq olov bilan yonadi va kichik portlash sodir bo'ladi. Kaliy yanada faolroq: bu holda portlash ancha kuchliroq bo'lib, olov rangli bo'ladi. binafsha. 2. Kislorod bilan o'zaro ta'siri. Ishqoriy metallarning havoda yonish mahsulotlari mavjud turli xil tarkib metallning faolligiga bog'liq.
Faqat litiy havoda yonib, stexiometrik tarkibli oksid hosil qiladi:
Natriy yonganda, Na2O2 peroksid asosan kichik NaO2 superoksid aralashmasi bilan hosil bo'ladi:
Kaliy, rubidiy va seziyning yonish mahsulotlarida asosan superoksidlar mavjud: ![]()
Natriy va kaliy oksidlarini olish uchun gidroksid, peroksid yoki superoksidning ortiqcha metall bilan aralashmalari kislorod yo'qligida isitiladi: 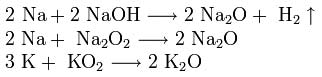
Ishqoriy metallarning kislorodli birikmalariga quyidagi qonuniyat xosdir: ishqoriy metallar kationining radiusi ortishi bilan peroksid ioni O22 va superoksid ioni O2- ni o'z ichiga olgan kislorod birikmalarining barqarorligi oshadi.
Og'ir gidroksidi metallar EO3 tarkibiga ega etarlicha barqaror ozonidlarning hosil bo'lishi bilan tavsiflanadi. Barcha kislorod birikmalari turli xil ranglarga ega, ularning intensivligi Li dan Cs gacha bo'lgan ketma-ketlikda chuqurlashadi:
|
Formula |
Rang |
|
Li2O |
Oq |
|
Na2O |
Oq |
|
K2O |
Sarg'ish |
|
Rb2O |
Sariq |
|
Cs2O |
Apelsin |
|
Na2O2 |
Nur |
|
KO 2 |
Apelsin |
|
RbO2 |
Qorong'i - |
|
CsO2 |
Sariq |
Ishqoriy metall oksidlari asosiy oksidlarning barcha xususiyatlariga ega: ular suv, kislotali oksidlar va kislotalar bilan reaksiyaga kirishadi: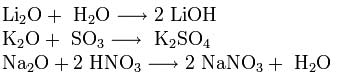
Peroksidlar va superoksidlar kuchli oksidlovchi moddalarning xususiyatlarini ko'rsatadi:
Peroksidlar va superoksidlar suv bilan intensiv o'zaro ta'sir qilib, gidroksidlarni hosil qiladi:
3. Boshqa moddalar bilan o'zaro ta'siri. Ishqoriy metallar ko'p metall bo'lmaganlar bilan reaksiyaga kirishadi. Qizdirilganda ular vodorod bilan birlashadi va hosil bo'ladi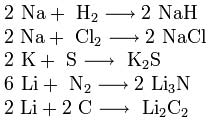 gidridlar, galogenlar, oltingugurt, azot, fosfor, uglerod va kremniy bilan mos ravishda galogenidlar, sulfidlar, nitridlar, fosfidlar, karbidlar va silisidlar hosil qiladi:
gidridlar, galogenlar, oltingugurt, azot, fosfor, uglerod va kremniy bilan mos ravishda galogenidlar, sulfidlar, nitridlar, fosfidlar, karbidlar va silisidlar hosil qiladi:
Ishqoriy metallar qizdirilganda boshqa metallar bilan reaksiyaga kirishib, intermetalik birikmalar hosil qiladi. Ishqoriy metallar kislotalar bilan faol (portlovchi) reaksiyaga kirishadi.
Ishqoriy metallar suyuq ammiak va uning hosilalari - aminlar va amidlarda eriydi:
Suyuq ammiakda eritilganda ishqoriy metall elektronni yo'qotadi, u ammiak molekulalari tomonidan eriydi va eritma ko'k rang beradi. Olingan amidlar suvda oson parchalanib, ishqor va ammiak hosil qiladi:
Ishqoriy metallar organik moddalar, spirtlar (alkogolatlar hosil qilish uchun) va karboksilik kislotalar (tuzlar hosil qilish uchun) bilan o'zaro ta'sir qiladi:
4. Sifatli ta'rif ishqoriy metallar. Ishqoriy metallarning ionlanish potentsiallari kichik bo'lganligi sababli, metall yoki uning birikmalari olovda qizdirilganda, atom ionlanadi va olovni ma'lum rangga bo'yaydi:
|
Ishqoriy metallar bilan olovni bo'yash |
|
|
Karmin qizil |
|
|
Sariq |
|
|
Binafsha |
|
|
Oq pushti |
|
|
Binafsha-qizil |
|
Ishqoriy metallarni tayyorlash
1. Ishqoriy metallarni olish uchun asosan ularning galogenidlari, ko'pincha tabiiy minerallar hosil qiluvchi xloridlar eritmalarini elektroliz qilishdan foydalanadilar:
katod: Li+ + e → Lianode: 2Cl- 2e → Cl22. Ba'zan ishqoriy metallarni olish uchun ular amalga oshiradilar
ularning gidroksidlari eritmalarini elektroliz qilish:
katod: Na+ + e → Naanod: 4OH- 4e → 2H2O + O2 Elektrokimyoviy kuchlanish qatoridagi gidroksidi metallar vodorodning chap tomonida joylashganligi sababli ularning tuz eritmalaridan elektrolitik hosil bo'lishi mumkin emas; bu holda tegishli ishqorlar va vodorod hosil bo'ladi.
Tabiatda ishqoriy metallar faqat birikmalar shaklida topilgan. Natriy va kaliy doimiydir komponentlar juda keng tarqalgan ko'plab silikatlar. Alohida natriy minerallaridan eng muhimi osh tuzi (NaCl). dengiz suvi yer yuzasining ayrim hududlarida esa allyuvial jinslar qatlami ostida tosh tuzi deb ataladigan ulkan konlarni hosil qiladi (SSSRda - Solikamsk, Artemoven, Iletsk va boshqalar). IN yuqori qatlamlar Shunga o'xshash konlarda ba'zan kaliy tuzlarining to'planishi [silvinit (KClNaCl minerallari shaklida), karnallit (KCl MgCl2 6H2 O) va boshqalar] mavjud bo'lib, ular ushbu element birikmalarining asosiy manbai bo'lib xizmat qiladi. Sanoat ahamiyatiga ega bo'lgan kaliy tuzlarining faqat bir nechta tabiiy birikmalari ma'lum. Ulardan eng muhimi SSSRdagi Solikamsk konidir.
Litiy uchun bir qator minerallar ma'lum [masalan, spodumen LiAl (SiO3) 2 ], lekin ularning to'planishi kamdan-kam uchraydi. Rubidiy va seziy deyarli faqat boshqa aralashmalar sifatida uchraydi ishqoriy metallar. Frantsiy izlari doimo uran rudalarida uchraydi.
Natriy va kaliy birikmalari hayot uchun katta ahamiyatga ega. Bir kishi har yili 510 kg NaCl iste'mol qilishini eslash kifoya, xuddi shunday, o'simliklar kaliy tuzlariga muhtoj. Shu munosabat bilan, barcha qazib olingan kaliy birikmalarining taxminan 90% tuproqni urug'lantirish uchun ishlatiladi. Qolgan 10%, shuningdek, ko'p miqdorda turli xil natriy birikmalari sanoatda qo'llaniladi. Hozirgacha lityum hosilalari va juda cheklangan Rb va Cs birikmalari faqat nisbatan kichik ilovalarni topdi.
Erkin holatda ishqoriy metallar erigan xlorid tuzlarini elektroliz qilish yo'li bilan ajratib olish mumkin. Natriy birlamchi amaliy ahamiyatga ega bo'lib, uning yillik jahon ishlab chiqarishi 50 ming tonnadan ortiq.
II guruhning asosiy kichik guruhiga elementlar kiradi b epu liy, magniy, kaltsiy, stronsiy, bariy va radiy. Bu elementlarning barchasi, berilliydan tashqari, aniq metall xususiyatlarga ega. Mavjud va ular kumushni ifodalaydi Risto-oq moddalar, gidroksidi metallarga qaraganda qattiqroq, erish nuqtalari ancha yuqori. Zichligi bo'yicha ularning barchasi, radiydan tashqari, engil metallarga tegishli.
Ko'rib chiqilayotgan kichik guruhning dastlabki ikki a'zosi unda boshqa to'rt elementdan ko'p jihatdan farq qiladigan bir oz alohida mavqega ega. B o'ziga xos ba'zilariga ko'ra erillium sifati alyuminiyga yaqinlashmoqda.
Kichik guruhning oxirgi elementi radiyning barcha izotoplari radioaktivdir. Uzoq umr ko'radigan izotop 226 Ra ilgari radioterapiyada ishlatilgan; endi u yadroviy reaktorlarda ishlab chiqarilgan boshqa elementlarning arzonroq izotoplari bilan almashtirildi.
Tashqi elektron qatlamda bu kichik guruh elementlarining atomlari ikkinchi tashqi qatlamda ikkita elektronga ega, berilliy ikkita elektronga ega, qolgan elementlar esa sakkiztaga ega.
Bu elementlarning atomlari hosil qilgan oddiy moddalar metallardir. Litiy, natriy, kaliy, rubidiy, seziy va fransiy ishqoriy metallar deb ataladi, chunki ularning gidroksidlari ishqordir. Kaltsiy, stronsiy va bariy ishqoriy tuproq metallari deyiladi. Bu moddalarning kimyoviy faolligi atom radiusi ortishi bilan ortadi. Bu metallarning kimyoviy xossalaridan eng muhimi ularning qaytaruvchi xossalaridir. Ishqoriy metallar eng kuchli qaytaruvchi moddalardir. IIA guruhi elementlarining metallari ham ancha kuchli qaytaruvchi moddalardir. Ularning barchasi (beriliydan tashqari) suv bilan reaksiyaga kirishadi (qaynatilganda magniy):
2M + 2H 2 O = 2M aq + 2OH aq + H 2,M + 2H 2 O = M 2 + 2OH + H 2.
Magniy, kaltsiy va stronsiy bo'lsa, hosil bo'lgan gidroksidlarning past eruvchanligi tufayli reaktsiya cho'kma hosil bo'lishi bilan birga keladi:
M 2 + 2OH = Mg(OH) 2
Ishqoriy metallar ko'pchilik nometallar bilan reaksiyaga kirishadi: 2M + H 2 = 2MH (qizdirilganda), 4M + O 2 = 2M 2 O (M Li), 2M + Cl 2 = 2MCl (normal sharoitda), 2M + S = M 2 S (qizdirilganda).
Ishqoriy metallardan kislorodda yondirilganda odatdagi oksid faqat litiy hosil qiladi. Qolgan gidroksidi metallar peroksidlar hosil qiladi (M 2 O 2 ) yoki superoksidlar (MO 2
formal zaryadga ega bo'lgan superoksid ionini o'z ichiga olgan birikmalar 1 e). Ishqoriy metallar singari, IIA guruhining metallari ham ko'plab nometalllar bilan reaksiyaga kirishadi, ammo og'irroq sharoitlarda: M + H. 2 = MH 2 (qizdirilganda; berilliydan tashqari),
2M+O 2
= 2MO (normal sharoitda; qizdirilganda Be va Mg), M + Cl 2 = MCl 2 (normal sharoitda), M + S = MS (qizdirilganda). Ishqoriy metallardan farqli o'laroq, ular kislorod bilan oddiy oksidlar hosil qiladi. Faqat magniy va berilyum kislotalar bilan tinchgina reaksiyaga kirishadi; oddiy moddalar juda shiddatli, tez-tez portlash bilan berilliy ishqorlarning konsentrlangan eritmalari bilan reaksiyaga kirishadi: Be + 2OH+ 2H 2 O = 2 + H 2
Kuchlanish seriyasidagi holatiga ko'ra, faqat berilliy va magniy tuz eritmalari bilan reaksiyaga kirishadi, bu holda qolgan metallar suv bilan reaksiyaga kirishadi. Ishqoriy va ishqoriy yer metallari kuchli qaytaruvchi moddalar boʻlgan holda oʻz birikmalaridan ancha kam faol metallarni kamaytiradi, masalan, qizdirilganda quyidagi reaksiyalar sodir boʻladi: 4Na+MnO 2 = 2Na 2 O + Mn 2Ca + SnO 2; = 2CaO + Sn Barcha ishqoriy metallar va IIA guruhi metallari uchun umumiy bo'lgan sanoat usuli erigan tuzlarning elektrolizidir.
Beriliydan tashqari barcha ko'rib chiqilayotgan elementlarning oksidlari asosli oksidlar, gidroksidlar esa kuchli asoslardir (berilliyda bu birikmalar amfoter, magniy gidroksidi zaif asosdir). Guruhdagi element atom sonining ortishi bilan gidroksidlarning asosiy xossalarining kuchayishi IIA guruh elementlarining gidroksidlari qatorida osonlik bilan kuzatiladi. Be(OH) 2
amfoter gidroksid, Mg(OH) 2
zaif asos, Ca(OH) 2, Sr(OH) 2 va Ba(OH) 2 kuchli asoslar, lekin atom soni ortishi bilan ularning eruvchanligi ortadi va Ba(OH) 2
allaqachon ishqorlar sifatida tasniflanishi mumkin.
Barcha ishqoriy tuproq metallari tabiatda (har xil miqdorda) uchraydi. Yuqori kimyoviy faollik tufayli ularning barchasi erkin holatda topilmaydi. Eng keng tarqalgan gidroksidi tuproqli metall kaltsiy bo'lib, uning miqdori 3,38% ni tashkil qiladi (er qobig'ining og'irligi bo'yicha). U magniydan biroz pastroq, uning miqdori 2,35% (er qobig'ining massasi). Tabiatda bariy va stronsiy ham keng tarqalgan bo'lib, ular mos ravishda er qobig'i massasining 0,05 va 0,034% ni tashkil qiladi. Berilliy noyob element bo'lib, uning miqdori er qobig'i massasining 6 × 10−4% ni tashkil qiladi. Radioaktiv bo'lgan radiyga kelsak, u barcha gidroksidi tuproq metallari orasida eng kam uchraydi, lekin uran rudalarida doimo oz miqdorda topiladi. Xususan, u erdan kimyoviy jihatdan ajratib olish mumkin. Uning tarkibi 1 × 10−10% (er qobig'i massasining) /
D.I.Mendeleyev davriy sistemasining III guruhining p-elementlariga quyidagilar kiradi: bor B, alyuminiy Al, galiy Ga, indiy In va talliy Tl. Elektron konfiguratsiya atomlar ns2 np1.
Quyida ko'rib chiqilayotgan guruhning p-elementlari atomlari va tegishli metall moddalarning xususiyatlarini tavsiflovchi ba'zi konstantalar solishtiriladi:
III guruh p-elementlarining xossalariga d-siqish ta'sir qiladi (Al davriy jadval kichik III davrda, katta davrlarda esa Ga, In va Tl d-elementlardan keyin darhol). Shunday qilib, Al dan Ga ga atom radiusi biroz kamayadi va birinchi ionlanish potentsiali ortadi. Bundan tashqari, f-siqish talliy atomlarining xususiyatlariga ham ta'sir qiladi. Shuning uchun ham Tl atomining radiusi In atomining radiusiga yaqin, ionlanish energiyasi esa biroz yuqoriroq.
Bor. Atomning elektron tuzilishiga ko'ra (1s2 2s2 2p1) bor bir valentli bo'lishi mumkin (2p energiya pastki darajasida bitta juftlashtirilmagan elektron). Biroq, bor uch valentli bo'lgan birikmalar uchun eng xarakterlidir (atom qo'zg'alganda, 2s va 2p energiya quyi darajalarida uchta juftlashtirilmagan elektron mavjud).
Qo'zg'atilgan bor atomidagi erkin 2p orbital uning ko'pgina birikmalarining akseptor xususiyatlarini aniqlaydi, ularda almashinish kovalent mexanizmiga ko'ra uchta kovalent bog'lanish hosil bo'ladi (masalan, Br3). Ushbu birikmalar elektron donorlik xususiyatiga ega bo'lgan zarrachalarning qo'shilishiga, ya'ni donor-akseptor mexanizmiga ko'ra boshqa kovalent bog'lanish hosil bo'lishiga moyil. Masalan:
BBr3 + Br- = [BBr4 ]-
Borning ikkita izotopi ma'lum: 105 B (19,6%) va 11 5 B (80,4%). Izotop atomlarining yadrolari (105 V) neytronlarni osongina yutadi:
105 V + 1 0 n = 4 2 He + 7 5 Li
Borning neytronlarni yutish qobiliyati uning yadro energiyasida ishlatilishini aniqlaydi: yadro reaktorlarining boshqaruv tayoqchalari bor o'z ichiga olgan materiallardan tayyorlanadi.
Bor kristallari qora; ular refrakter (mp 2300 °C), diamagnit va yarimo'tkazgich xususiyatlariga ega (band oralig'i DE = 1,55 eV). Borning elektr o'tkazuvchanligi, boshqa metallar kabi, past va harorat oshishi bilan bir oz ortadi.
At xona harorati bor kimyoviy jihatdan inert va faqat ftor bilan bevosita o'zaro ta'sir qiladi; Bor qizdirilganda xlor, kislorod va boshqa ba'zi metall bo'lmaganlar bilan oksidlanadi. Masalan:
4B + 3O2 = 2B2 O3
2V + ZSl2 = 2VSl3
Metall bo'lmagan birikmalarda borning oksidlanish darajasi +3; bu birikmalarning barchasi kovalentdir.
Bor trioksidi B2 O3 kristalli moddadir (mp 450 °C, qaynash nuqtasi 2250 °C), yuqori entalpiya qiymatlari va Gibbs hosil bo'lish energiyasi bilan tavsiflanadi. Suv bilan o'zaro ta'sirlashganda, B2 O3 ga aylanadi borik kislotasi:
B2 O3 + ZH2 O = 2H3 BO3
H3 BO3 juda zaif (Kd ≈ 10-9) bir asosli kislotadir. H3 BO3 ning faqat bitta H+ ionini yo‘q qilish bilan elektrolitik dissotsiatsiyasi borning ilgari tasvirlangan akseptorlik xususiyatlari bilan izohlanadi: bor atomining erkin 2p orbitali H2 O molekulalarining dissotsiatsiyasi jarayonida hosil bo‘lgan OH- elektron donoriga beriladi. Jarayon sxema bo'yicha davom etadi
H3 BO3 + H2 O = H[B(OH)4 ] = H+ + [B(OH)4]-
Kompleks anion [B(OH)4]- tetraedral tuzilishga ega (sp3 - elektron orbitallarning gibridlanishi). Oksidlanish darajasi + 3 bo'lgan birikmalardagi borning qabul qiluvchi xossalari uning galogenidlari kimyosida ham namoyon bo'ladi. Masalan, reaktsiyalar
BF3 + F- = -
BF3 + NH3 =
unda BF va F- yoki NH3 o'rtasidagi kimyoviy bog'lanish donor-akseptor mexanizmi orqali hosil bo'ladi. Bor galogenidlarining elektron qabul qiluvchi bo'lish xususiyati ularni belgilaydi keng qo'llanilishi organik birikmalar sintezi reaksiyalarida katalizator sifatida.
Bor vodorod bilan toʻgʻridan-toʻgʻri taʼsir oʻtkazmaydi, lekin metallar bilan boridlar hosil qiladi, odatda Me4B, Me2B, MeB, Me3B4, MeB2 va MeB6 stoxiometrik boʻlmagan birikmalar hosil qiladi.
Bor gidridlari (boranlar) juda zaharli va juda ko'p yomon hid. Ular ko'pincha bilvosita olinadi
Kimyoviy faol boridlarni kislotalar bilan yoki bor galogenidlarini gidroksidi metall gidridlari bilan reaksiyaga solishda:
6MgB2 + 12HCl = H2 + 8B + B4 H10 + 6MgCl2
8BF3 + 6LiH = B2 H6 + 6LiBF4
Borning vodorod BH3 bilan eng oddiy birikmasi oddiy sharoitda mavjud emas, sp2 - Bor atomidagi elektron orbitallarning gibridlanishi BH3 zarrasining koordinatsion to'yinmaganligiga olib keladi, buning natijasida ikkita bunday zarracha diboran molekulasiga birlashadi: 2BH3 = B2 H6 (DG0 298 = -127 kJ/mol).
Diboran B2H6 da bor 5p3 gibridlanish holatida bo'ladi va har bir bor atomi uchun to'rtta gibrid orbitaldan biri bo'sh, qolgan uchtasi esa vodorod atomlarining s-orbitallari bilan qoplangan. B2H6 molekulasidagi BH3 guruhlari orasidagi bog'lanishlar elektron zichligining BH3 guruhining bir vodorod atomidan boshqa BH3 guruhining bo'sh orbitaliga siljishi tufayli vodorod bog'i sifatida hosil bo'ladi. Bn Hn+4 va Bn Hn+6 ikki qator bilan ifodalanishi mumkin bo'lgan boshqa boranlar ham ma'lum.
S-metall boridlar reaktivdir va ko'pincha kislotalar bilan ishlov berish orqali bor aralashmalarini ishlab chiqarish uchun ishlatiladi. d- va f-metallarning aksariyat boridlari issiqlikka chidamli, juda qattiq va kimyoviy jihatdan barqarordir. Ular to'g'ridan-to'g'ri reaktiv dvigatel qismlari va gaz turbinasi pichoqlarini ishlab chiqarish uchun qotishmalar shaklida keng qo'llaniladi. Ba'zi boridlar elektron qurilmalarning katodlarini tayyorlash uchun ishlatiladi.
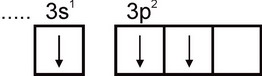
alyuminiy. Alyuminiy atomining elektron konfiguratsiyasi 1s2 2s2 2p6 3s2 3p1 formula bilan ifodalanadi. Atomning eng tashqi elektron qatlamida bitta juftlashtirilmagan elektron mavjud:
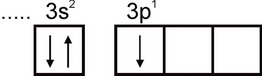
Shuning uchun alyuminiy bir valentlikni namoyon qilishi mumkin. Biroq, bu valentlik alyuminiy uchun xos emas. Barcha barqaror birikmalarda alyuminiyning oksidlanish darajasi +3 ga teng. Uch valentlik Al atomining qo'zg'aluvchan holatiga to'g'ri keladi:
O'zining ko'pligi bo'yicha alyuminiy barcha elementlar (O, H va Si dan keyin) to'rtinchi o'rinni egallaydi va tabiatda eng keng tarqalgan metalldir. Alyuminiyning asosiy qismi aluminosilikatlarda to'plangan: dala shpatlari, slyudalar va boshqalar.
Alyuminiy kumush-oq, engil va juda egiluvchan metall, yuqori issiqlik va elektr o'tkazuvchanligiga ega.
Alyuminiy kimyoviy jihatdan faol; Xona haroratida xlor va brom bilan, qizdirilganda yoki katalizator sifatida suv ishtirokida yod bilan reaksiyaga kirishadi. 800 ° C da alyuminiy azot bilan, 2000 ° C da uglerod bilan reaksiyaga kirishadi. Alyuminiy kislorodga yuqori kimyoviy yaqinlik ko'rsatadi (DG0 298 = -1582 kJ/mol):
2Al + 0,502 = Al2 O3, DH0 298 = -1650 kJ/mol
Havoda alyuminiy juda bardoshli, yupqa (10-8 m) oksidli plyonka bilan qoplangan, bu alyuminiyning metall yorqinligini biroz zaiflashtiradi. Oksid plyonkasi tufayli alyuminiy sirt yuqori korroziyaga qarshilikka ega bo'ladi. Bu, birinchi navbatda, alyuminiyning suv va suv bug'iga befarqligida namoyon bo'ladi. Himoya plyonkasi shakllanishi tufayli alyuminiy konsentrlangan nitrat va sulfat kislotalarga chidamli. Bu kislotalar sovuqda alyuminiyni passivlashtiradi. Passivatsiya tendentsiyasi alyuminiyning korroziyaga chidamliligini uning yuzasini kuchli oksidlovchi moddalar (masalan, K2 Cr2 O7) bilan ishlov berish yoki anodik oksidlanish yordamida oshirish imkonini beradi. Bunda oksid plyonkasi qalinligi 3·10-5 m gacha oshadi yuqori haroratlar himoya plyonkaning kuchi keskin kamayadi. Agar mexanik ta'sir oksid plyonkasini olib tashlang, alyuminiy juda reaktiv bo'ladi. U suv va kislotalar va ishqorlarning suvli eritmalari bilan kuchli reaksiyaga kirishib, vodorodni siqib chiqaradi va kationlar yoki anionlar hosil qiladi. Alyuminiyning kislota eritmalari bilan o'zaro ta'siri reaksiya tenglamasiga muvofiq davom etadi
Al + 6H2 O + 3H+ = [Al(H2 O)6 ]3+ + 0,5H2
va ishqor eritmalari bilan
Al + 3H2 O + OH- = [Al(OH)4 ]- + 0,5H2
Eritmaning pH qiymati o'zgarganda alyuminiy kationlari va anionlari osongina bir-biriga aylanadi:
[Al(H2 O)6 ]3+ + 4OH- = [Al(OH)4 ]- + 6H2 O
[Al(OH)4 ]- + 4H+ + 2H2 O = [Al(H2 O)6 ]3+
Aralash birikmalar eritmada ham hosil bo'lishi mumkin, masalan, [Al(H2 O)5 (OH)]2+, [Al(H2 O)4 (OH)2 ]+, [Al(H2 O)3 (OH)3 ] . Ikkinchisi osongina (ayniqsa qizdirilganda) suvsizlanadi va gidroksid Al (OH) 3 ga aylanadi:
[Al(H2 O)3 (OH)3 ] = Al(OH)3 + 3H2 O
Texnologiyada alyuminiyning eng keng qo'llanilishi uning qimmatli jismoniy va kimyoviy xossalari va er qobig'ida keng tarqalgan. Yuqori elektr o'tkazuvchanligi (4·10-5 Om-1 sm-1) va past zichlik tufayli elektr simlarini ishlab chiqarish uchun ishlatiladi. Alyuminiyning yuqori egiluvchanligi undan eng nozik folga yasashga imkon beradi, u kondansatörlarda ishlatiladi va simi qoplamalarida qo'rg'oshinni alyuminiy bilan almashtiradi. Magnitlanmasligi tufayli alyuminiy qotishmalari radiotexnikada qo'llaniladi.
Alyuminiyning asosiy qismi engil qotishmalar ishlab chiqarish uchun ishlatiladi: duralumin (94% Al, qolgan Cu, Mg, Mn, Fe va Si), silumin (85 x 90% Al, 10 x 14% Si, qolgan Na) va boshqalar. Alyuminiy qo'shimcha ravishda, qotishmalarga issiqlikka chidamlilik berish uchun qotishma qo'shimchasi sifatida ishlatiladi. Alyuminiy va uning qotishmalari samolyotsozlik, raketasozlik, mashinasozlik va boshqalarda konstruktiv materiallar sifatida asosiy o'rinlardan birini egallaydi. Alyuminiyning korroziyaga chidamliligi (ayniqsa, anodlangan) po'latning korroziyaga chidamliligidan sezilarli darajada oshadi. Shuning uchun uning qotishmalari konstruktiv materiallar sifatida va kemasozlikda ishlatiladi. d-elementlar bilan alyuminiy kimyoviy birikmalar hosil qiladi - intermetalidlar (alyuminidlar): NiAl, Ni3 Al, CoAl va boshqalar, ular issiqlikka chidamli materiallar sifatida ishlatiladi. Alyuminiy aluminotermiyada bir qancha metallarni olish va termit usulida payvandlash uchun ishlatiladi. Aluminotermiya alyuminiyning kislorodga yuqori yaqinligiga asoslangan. Masalan, tenglama bo'yicha ketayotgan reaksiyada
8Al + 3Fe3 O4 = 4Al2 O3 + 9Fe
Taxminan 3500 kJ issiqlik chiqariladi va harorat 3000 ° C ga etadi.
Alyuminiy oksidi bir nechta modifikatsiyalar shaklida ma'lum. Eng barqarori a-Al2 O3. Ushbu modifikatsiya er qobig'ida mineral korund shaklida mavjud bo'lib, undan silliqlash disklari va zımpara kukunlari tayyorlanadi. Korunddan abraziv material sifatida foydalanish uning yuqori qattiqligiga asoslanadi, faqat olmos, SiC karborund va BN borazon qattiqligidan keyin ikkinchi o'rinda turadi. Al2 O3 ni Cr2 O3 bilan birlashtirib, olinadi sun'iy yoqutlar. Ular nozik mexanizmlarda qo'llab-quvvatlovchi toshlarni tayyorlash uchun ishlatiladi. IN yaqinda sun'iy yoqutlar kvant generatorlarida (lazerlarda) ishlatiladi. Al2O3 dan tayyorlangan mahsulotlar refrakterlar va dielektriklar sifatida ishlatiladi.
Alyuminiy gidroksid Al(OH)3 polimer birikmasi. U qatlamli kristall panjaraga ega. Har bir qatlam Al(OH)6 oktaedrdan iborat (1-rasm); Qatlamlar orasida vodorod aloqasi mavjud. Alyuminiy gidroksidi almashinuv reaktsiyasi natijasida olingan jelatinli oq cho'kma bo'lib, kislotalar va ishqorlarda yaxshi eriydi. Tik turganda cho'kma "qariydi" va kimyoviy faolligini yo'qotadi. Kalsinlanganda gidroksid suvni yo'qotadi va Al2O3 oksidiga aylanadi. Suvsiz gidroksidning shakllaridan biri alyuminiy gel adsorbent sifatida texnologiyada qo'llaniladi.
Aluminosilikatlar bilan bog'liq bo'lgan alyuminiy birikmalari zeolitlari juda katta qiziqish uyg'otadi. Ularning tarkibi umumiy formula Meh Eu O2y ·nH2 O bilan ifodalanishi mumkin, bu erda MeCa yoki Na (kamroq Ba, Sr, K); E Si va Al o'zgaruvchan nisbatda. Zeolit kristallari H2O molekulalari kirib borishi mumkin bo'lgan kanallarga ega. Zeolitlar tarkibidagi suvni boshqa suyuqliklarga (spirtli ichimliklar va boshqalar) almashtirishga qodir. Yumshoq isitish bilan suv asta-sekin zeolitlardan chiqariladi. Ammo hatto to'liq suvsizlanish ham zeolit kristallarini yo'q qilishga olib kelmaydi. Seolitlardagi Ca2+ yoki Na+ kationlari diffuziya qatlamini hosil qiladi; ular kristall panjarada mahkamlanmagan, lekin suv bilan birga kristallning bo'shliqlarida joylashgan. Bu zeolitlarda texnik maqsadlar uchun muhim bo'lgan kation almashish xususiyatlarining mavjudligini tushuntiradi. Ba'zi kationlarni boshqalar bilan almashtirish qobiliyati seolitlarni ion almashinuvchisi sifatida ishlatishga imkon beradi.
Bir qator sun'iy zeolitlar molekulyar elaklar deb ataladi. Ikkinchisining kristallari diametri 3 · 10-10 dan 13 · 10-10 m gacha bo'lgan tor kanallarning mavjudligi bilan tavsiflanadi, molekulalari bu teshiklarga kirishi mumkin bo'lgan moddalarni o'zlashtiradi.
Masalan, diametri 3,5 x 10-10 m bo'lgan molekulyar elak H2, O2, N2 molekulalarini o'zlashtira oladi, lekin kattaroq CH4 yoki Ar molekulalarini o'zlashtirmaydi. Molekulyar elaklardan foydalanib, siz uglevodorodlarni, quruq gazlarni va boshqalarni ajratishingiz mumkin.
Oddiy moddalar holidagi galiy, indiy va talliy kam eriydigan kumush-oq metallardir. Ga, In va Tl ning fizik va kimyoviy xossalari ko'rib chiqilayotgan elementlar atomlarining tashqi energiya darajasining elektron tuzilishining o'xshashligiga qaramasdan, Al xususiyatlaridan sezilarli darajada farq qiladi.
Bu, ehtimol, Al atomlarining tashqi energiya darajasining elektron tuzilishidagi farq bilan bog'liq: bir tomondan (n-1)s2 (n-1)p6 va boshqa tomondan Ga, In va Tl atomlari: ( n-1)s2 (n- 1)r6 (n-1)d10 .
Barqaror birikmalarda galiy va indiyning oksidlanish darajasi +3 ga teng. Metallning oksidlanish darajasi +3 bo'lgan talliy birikmalari uchun +1 oksidlanish darajasi kuchli oksidlovchi moddalardir.
Galliy suyuqlik holatining keng harorat oralig'iga ega. Past erish nuqtasi (taxminan 30 ° C) va yuqori qaynash nuqtasi (2205 ° C) bosim o'lchagichlarini ishlab chiqarish uchun suyuq galyumdan foydalanishga imkon beradi.
Indiy barcha to'lqin uzunliklarining yorug'lik to'lqinlarini bir xilda aks ettiradi va shuning uchun nometall ishlab chiqarish uchun nozik asboblarda qo'llaniladi. Bundan tashqari, In ba'zi past eriydigan qotishmalarning bir qismidir.
Talliy, shuningdek, ba'zi qotishmalarga, asosan qalay va qo'rg'oshinli qotishmalarga (kislota chidamli, podshipnik) kiritiladi.
Ga2 O3, In2 O3 va Tl2 O3 oksidlari suvda amalda erimaydi. Ga2 O3 In2 O3 Tl2 O3 qatoridagi asosiy xususiyatlarning sezilarli o'sishi oksidlarning kislotalarda eruvchanligini oshirishda namoyon bo'ladi.
Ga(OH)3, In(OH)3, Tl(OH)3 gidroksidlari oksidlar kabi suvda erimaydi. Ga(OH)3 ning oq cho`kmasi kislotalar va ishqorlarda, qizil-jigarrang Tl(OH)3 esa faqat kislotalarda eriydi.
Galiy va indiy davriy sistemaning V guruhining p-elementlari (masalan, GaP, GaAs, InSb va boshqalar) bilan AIII BV tipidagi binar birikmalar hosil qiladi. AIII BV tipidagi birikmalarning aksariyatida elektron orbitallar sp3-gibridlangan; bu birikmalarning kristall panjaralari kimyoviy bog'lanishlarning tetraedral joylashuvi bilan tavsiflangan tuzilishga ega. Ushbu olmosga o'xshash birikmalarning aksariyati yarim o'tkazgichlardir. Ular AC rektifikatorlari, sensorlar, termoelektr generatorlari va boshqalar uchun material sifatida ishlatiladi.
Uglerod, kremniy, germaniy, qalay va qo'rg'oshin IV guruhning asosiy kichik guruhini tashkil qiladi. IV guruh p-elementlarining tashqi energiya darajalari to'rtta elektronni (ns2np2 konfiguratsiyasi) o'z ichiga oladi, ulardan ikkitasi juftlashgan s-elektron va ikkita juftlashtirilmagan p-elektrondir.
Qo'zg'atmagan holatda ushbu kichik guruhning elementlari ikkita valentlikni namoyon qiladi. Tashqi darajadagi s-elektronlardan birining bir xil darajadagi p-kichik darajadagi erkin hujayraga o'tishi bilan birga qo'zg'aluvchan holatga o'tganda, tashqi qatlamning barcha elektronlari juftlashtirilmaydi va valentlik kuchayadi. 4.
Oltingugurt, selen, tellur va poloniy ham mavjud tashqi daraja 6 elektron (s 2 p 4 ), lekin ularning barchasi to'ldirilmagan d-darajaga ega, shuning uchun ular 6 tagacha juftlashtirilmagan elektronga ega bo'lishi mumkin va birikmalarda -2, +4 va +6 oksidlanish darajasini ko'rsatishi mumkin.
Ushbu elementlarning faolligidagi o'zgarishlar sxemasi galogenlarning kichik guruhidagi kabi: telluridlar eng oson oksidlanadi, keyin selenidlar va sulfidlar. Oltingugurtning kislorodli birikmalaridan eng barqarori oltingugurt (VI) birikmalari, tellur uchun esa tellur (IV) birikmalaridir. Selen birikmalari oraliq pozitsiyani egallaydi.
Xrom kichik guruhining elementlarida d-darajasi to'ldiriladi, shuning uchun ularning atomlarining s-darajasida 1 ta (xrom va molibden uchun) yoki 2 ta (volfram uchun) elektron mavjud. Ularning barchasi +6 maksimal oksidlanish darajasini ko'rsatadi, ammo molibden va ayniqsa xrom, ular past oksidlanish darajasiga ega bo'lgan birikmalar bilan tavsiflanadi (molibden uchun +4 va xrom uchun +3 yoki +2). Xrom (III) birikmalari juda barqaror va alyuminiy birikmalariga o'xshaydi.
Xrom kichik guruhining barcha metallari keng qo'llaniladi.
Molibden birinchi marta 1778 yilda K. V. Scheele tomonidan olingan. U qurol bochkalari, zirhlar, shaftalar va boshqalarni ishlab chiqarish uchun ishlatiladigan yuqori quvvatli va qattiq po'latlarni ishlab chiqarishda qo'llaniladi.
Yuqori haroratlarda bug'lanish qobiliyati tufayli u filamentlarni tayyorlash uchun juda kam qo'llaniladi, lekin shisha bilan eritish qobiliyati yaxshi, shuning uchun u cho'g'lanma lampalardagi volfram filament ushlagichlarini tayyorlash uchun ishlatiladi.
Volfram 1781 yilda K.V.Scheele tomonidan ham kashf etilgan.U maxsus po'latlarni ishlab chiqarish uchun ishlatiladi. Po'latga volfram qo'shilishi uning qattiqligi, elastikligi va mustahkamligini oshiradi. Xrom bilan birgalikda volfram po'latga juda yuqori haroratlarda qattiqlikni saqlash qobiliyatini beradi, shuning uchun bunday po'latlar yuqori tezlikda ishlaydigan stanoklar uchun kesgichlar tayyorlash uchun ishlatiladi.
Sof volfram metallar orasida eng yuqori erish nuqtasiga ega (3370 ° C), shuning uchun u cho'g'lanma lampalardagi filamentlarni ishlab chiqarish uchun ishlatiladi. Volfram karbid juda yuqori qattiqlik va issiqlik qarshiligiga ega va asosiy hisoblanadi ajralmas qismi o'tga chidamli qotishmalar.
Azot kichik guruhi besh elementdan iborat: azot, fosfor, mishyak, surma va vismut. Bular D. I. Mendeleyev davriy sistemasining V guruhining p-elementlari.Tashqi energiya darajasida ushbu elementlarning atomlari beshta elektronni o'z ichiga oladi, ular ns2np3 konfiguratsiyasiga ega va quyidagicha taqsimlanadi:
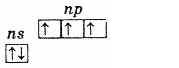
Shuning uchun bu elementlarning eng yuqori oksidlanish darajasi +5, eng pasti -3 va +3 ham xarakterlidir tashqi sathda uchta juftlashtirilmagan elektronning mavjudligi qo'zg'atmagan holatda elementlarning atomlari valentlikka ega ekanligini ko'rsatadi. 3. Azot atomining tashqi sathi faqat ikkita kichik darajali 2s va 2p dan iborat. Ushbu kichik guruhning qolgan elementlarining atomlari tashqi xususiyatga ega energiya darajalari bo'sh bo'lgan d-pastki darajali hujayralar mavjud. Binobarin, tashqi sathning s-elektronlaridan biri qo`zg`alganda bir xil darajadagi d-kichik darajaga o`tishi mumkin, bu esa 5 ta juftlanmagan elektron hosil bo`lishiga olib keladi.
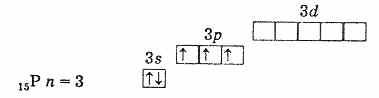
fosforning tashqi elektron qobig'i (qo'zg'atmagan atom)
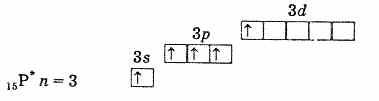
qo'zg'atilgan fosfor atomining tashqi elektron qobig'i Shunday qilib, qo'zg'atilgan holatdagi fosfor, mishyak, surma va vismutda 5 ta juftlashtirilmagan elektron mavjud va ularning bu holatda valentligi 5. Azot atomida elektronni qo'zg'ating. shunga o'xshash tarzda ikkinchi darajadagi d-kichik daraja yo'qligi sababli mumkin emas. Shuning uchun azot besh valentli bo'la olmaydi, lekin u 2s2 yolg'iz elektron juftligi tufayli donor-akseptor mexanizmi orqali to'rtinchi kovalent bog'lanish hosil qilishi mumkin. Azot atomi uchun boshqa jarayon ham mumkin. Ikki 2s elektrondan biri chiqarilganda azot bir zaryadli tetravalent ion N+ ga aylanadi.

Azotdan vismutgacha atom radiuslari ortadi, ionlanish potentsiallari esa kamayadi. Neytral atomlarning qaytaruvchi xossalari N dan Bi gacha oshadi, oksidlovchi xossalari esa zaiflashadi (21-jadvalga qarang).
Vodorod, azot, fosfor va mishyak bilan RH3 qutbli birikmalar hosil bo'lib, salbiy oksidlanish holatini -3 ko'rsatadi. RH3 molekulalari piramidal shaklga ega. Ushbu birikmalarda elementlarning vodorod bilan bog'lanishi kislorod kichik guruhi va ayniqsa halogen kichik guruhi elementlarining mos keladigan birikmalariga qaraganda kuchliroqdir. Shuning uchun suvli eritmalardagi azot kichik guruhi elementlarining vodorod birikmalari vodorod ionlarini hosil qilmaydi.
Kislorod bilan azot kichik guruhining elementlari R2O3 va R2O5 umumiy formulali oksidlarni hosil qiladi. Oksidlar HRO2 va HRO3 kislotalariga (va H3RO4 orto kislotalariga, azotdan tashqari) mos keladi. Kichik guruh ichida oksidlarning tabiati quyidagicha o'zgaradi: N2O3 kislota oksidi; R4O6 kuchsiz kislotali oksid; As2O3 amfoter oksidi ustun kislotali xususiyatlarga ega; Asosiy xususiyatlarga ega Sb2O3 amfoter oksidi; Bi2O3 asosiy oksidi. Shunday qilib, R2O3 va R2O5 tarkibidagi oksidlarning kislotali xossalari elementning atom soni ortishi bilan kamayadi. 21, azotdan vismutgacha bo'lgan kichik guruh ichida metall bo'lmagan xususiyatlar pasayadi va metall xususiyatlar ortadi. Surmada bu xossalar vismutda teng ifodalanadi, azotda metalllik xossalari ustunlik qiladi; Fosfor, mishyak va surma bir qancha allotropik birikmalar hosil qiladi.
Elementlarning davriy sistemasining oltinchi guruhi ikkita kichik guruhdan iborat: asosiy guruh - kislorod, oltingugurt, selen, tellur va poloniy va ikkinchi darajali guruh - xrom, molibden va volfram. Asosiy kichik guruhda selen kichik guruhi (selen, tellur va poloniy) ajralib turadi, ikkilamchi kichik guruh xrom kichik guruhi deb ataladi. Kisloroddan tashqari asosiy kichik guruhning barcha elementlari elektronegativ ionlarni hosil qiluvchi ikkita elektronni qo'shishi mumkin.
Asosiy kichik guruhning elementlari tashqi elektron sathida oltita elektronga (s2p4) ega. Kislorod atomlari ikkita juftlashtirilmagan elektronga ega va d-darajasi yo'q. Shuning uchun kislorod asosan oksidlanish darajasini ko'rsatadi (2 va faqat ftor +2 bo'lgan birikmalarda. Oltingugurt, selen, tellur va poloniy ham tashqi sathida oltita elektronga ega (s2p4), lekin ularning barchasi to'ldirilmagan d-darajaga ega, shuning uchun ular oltitagacha juftlashtirilmagan elektronga ega va birikmalarda 2, +4 va +6 oksidlanish darajasini ko'rsatadi.
Ushbu elementlarning faolligidagi o'zgarishlar sxemasi galogenlarning kichik guruhidagi kabi: telluridlar eng oson oksidlanadi, keyin selenidlar va sulfidlar. Oltingugurtning kislorodli birikmalaridan eng barqarori oltingugurt (VI) birikmalari, tellur uchun esa tellur (IV) birikmalaridir. Selen birikmalari oraliq pozitsiyani egallaydi.
Selen va tellur, shuningdek, ularning ma'lum metallar bilan birikmalari (indiy, talliy va boshqalar) yarim o'tkazuvchanlik xususiyatiga ega va radioelektronikada keng qo'llaniladi. Selen va tellur birikmalari juda zaharli hisoblanadi. Ular ichida ishlatiladi shisha sanoati rangli (qizil va jigarrang) ko'zoynaklar ishlab chiqarish uchun.
Xrom kichik guruhining elementlarida d-darajasi to'ldiriladi, shuning uchun ularning atomlarining s-darajasida bitta (xrom va molibden uchun) yoki ikkita (volfram uchun) elektron mavjud. Ularning barchasi +6 maksimal oksidlanish darajasini ko'rsatadi, ammo molibden va ayniqsa xrom, ular past oksidlanish darajasiga ega bo'lgan birikmalar bilan tavsiflanadi (molibden uchun +4 va xrom uchun +3 yoki +2). Xrom (III) birikmalari juda barqaror va alyuminiy birikmalariga o'xshaydi. Xrom kichik guruhining barcha metallari keng qo'llaniladi.
Molibden birinchi marta 1778 yilda K.V.Scheele tomonidan olingan. U qurol bochkalari, zirhlar, oʻqlar va boshqalar ishlab chiqarishda qoʻllaniladi. filamentlarni ishlab chiqarish uchun juda oz foydalanish , lekin shisha bilan eritish uchun yaxshi qobiliyatga ega, shuning uchun u cho'g'lanma lampalarda volfram filament ushlagichlarini tayyorlash uchun ishlatiladi.
Volfram ham 178 yilda K.V.Scheele tomonidan kashf etilgan! d) maxsus po'latlarni ishlab chiqarish uchun ishlatiladi. Po'latga volfram qo'shilishi uning qattiqligi, elastikligi va mustahkamligini oshiradi. Xrom bilan birgalikda volfram po'latga juda yuqori haroratlarda qattiqlikni saqlash qobiliyatini beradi, shuning uchun bunday po'latlar yuqori tezlikda ishlaydigan stanoklar uchun kesgichlar tayyorlash uchun ishlatiladi. Sof volfram metallar orasida eng yuqori erish nuqtasiga ega (3370 (C), shuning uchun u cho'g'lanma lampalardagi filamentlarni ishlab chiqarish uchun ishlatiladi. Volfram karbidi juda qattiq va issiqlikka chidamli bo'lib, o'tga chidamli qotishmalarning asosiy komponenti hisoblanadi.
Davriy jadvalning VII guruhiga kiritilgan elementlar 2 kichik guruhga bo'linadi: asosiysi - galogen kichik guruhi - va ikkinchi darajali - marganets kichik guruhi. Vodorod ham xuddi shu guruhga joylashtirilgan, garchi uning atomi tashqi valentlik darajasida bitta elektronga ega bo'lsa va I guruhga joylashtirilishi kerak.
Biroq, vodorodning asosiy kichik guruh elementlari - ishqoriy metallar va ikkilamchi kichik guruh elementlari - mis, kumush va oltin bilan juda kam umumiylik mavjud. Shu bilan birga, galogenlar kabi, faol metallar bilan reaksiyalarda elektron qo'shib, galogenidlar bilan qandaydir o'xshashliklarga ega bo'lgan gidridlarni hosil qiladi.
Galogenlarning kichik guruhiga ftor, xlor, brom, yod va astatin kiradi. Dastlabki 4 ta element tabiatda uchraydi, oxirgisi sun'iy yo'l bilan olinadi va shuning uchun boshqa galogenlarga qaraganda ancha kam o'rganilgan. "Galogen" so'zi tuz hosil qiluvchi degan ma'noni anglatadi. Kichik guruhning elementlari ko'plab metallar bilan reaksiyaga kirishib, tuzlar hosil qilish qulayligi tufayli bunday nom oldi.
Barcha galogenlar tashqi elektron qobiqli tuzilishga ega s 2p5 . Shuning uchun ular elektronni osongina qabul qilib, barqaror olijanob gaz elektron qobig'ini hosil qiladi (s 2 r 6 ). Ftor kichik guruhdagi eng kichik atom radiusiga ega, qolganlari uchun u F qatorida ortadi< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
Galogenlar - juda faol elementlar. Ular elektronlarni nafaqat o'zlaridan osongina voz kechadigan atomlardan, balki ionlardan ham olishlari va hatto faolligi kam bo'lgan boshqa galogenlarni birikmalaridan siqib chiqarishlari mumkin. Masalan, ftor xlorni xloridlardan, bromni bromidlardan, yodni yodidlardan siqib chiqaradi.
Barcha galogenlardan faqat II davrdagi ftor to'ldirilmagan d-darajaga ega emas. Shu sababli, u 1 dan ortiq juftlashtirilmagan elektronga ega bo'lishi mumkin emas va faqat -1 valentligini namoyish etadi. Boshqa galogenlarning atomlarida d-darajasi to'ldirilmaydi, bu ularga turli xil miqdordagi juftlashtirilmagan elektronlarga ega bo'lish imkonini beradi va kislorod birikmalarida kuzatiladigan -1, +1, +3, +5 va +7 valentliklarni namoyon qiladi. xlor, brom va yod.
Marganets kichik guruhiga marganets, texnetiy va reniy kiradi. Galogenlardan farqli o'laroq, marganets kichik guruhining elementlari tashqi elektron sathida faqat 2 ta elektronga ega va shuning uchun manfiy zaryadlangan ionlarni hosil qilib, elektronlarni biriktirish qobiliyatini namoyish etmaydi.
Marganets tabiatda juda ko'p va sanoatda keng qo'llaniladi.
Texnetiy radioaktiv boʻlib, tabiatda uchramaydi, lekin sunʼiy yoʻl bilan olingan (birinchi marta E. Segre va C. Perrier, 1937 y. Bu element uranning radioaktiv parchalanishi natijasida hosil boʻlgan). Reniy mikroelementlardan biridir. U mustaqil minerallar hosil qilmaydi, lekin ba'zi minerallar, ayniqsa molibdenning hamrohi sifatida topiladi.
Uni 1925-yilda V. va I. Noddaklar kashf etgan. Kichik reniy qoʻshilgan qotishmalar korroziyaga chidamliligini oshirgan. Qotishmalarga reniy qo'shilishi ularning mexanik mustahkamligini oshiradi.
Reniyning bu xususiyati uni o'rniga ishlatishga imkon beradi olijanob metall iridiy. Platina-platina-reniy termojuftlari platina-platina-iridiy termojuftlariga qaraganda yaxshiroq ishlaydi, lekin ularni juda yuqori haroratlarda ishlatib bo'lmaydi, chunki uchuvchan Re birikmasi hosil bo'ladi. 2 O 7 .
Davriy jadvalning sakkizinchi guruhining asosiy kichik guruhi asil gazlardan iboratgeliy, neon, argon, kripton, ksenon va radon. Ushbu elementlar juda past kimyoviy faollik bilan ajralib turadi, bu ularni olijanob yoki inert gazlar deb atashga sabab bo'ladi. Ular faqat qiyinchilik bilan boshqa elementlar yoki moddalar bilan birikmalar hosil qiladi; geliy, neon va argonning kimyoviy birikmalari olinmagan. Asil gazlarning atomlari molekulalarga birlashtirilmaydi, boshqacha aytganda, ularning molekulalari monotomikdir.
Asil gazlar elementlar tizimining har bir davrini tugatadi. Geliydan tashqari ularning barchasi atomning tashqi elektron qatlamida sakkizta elektronga ega bo'lib, juda barqaror tizimni tashkil qiladi. Ikki elektrondan iborat geliyning elektron qobig'i ham barqarordir. Shuning uchun asil gaz atomlari yuqori ionlanish energiyalari va qoida tariqasida manfiy elektron yaqinlik energiyasi bilan ajralib turadi.
Uzoq vaqt davomida; anchadan beri asil gaz atomlari odatda boshqa elementlarning atomlari bilan kimyoviy bog'lanishga qodir emas, deb ishonilgan. Asil gazlarning faqat nisbatan beqaror molekulyar birikmalari, masalan, gidratlar ma'lum edi
Ag-6N 2 0, Kg-6N 2 0, Xe-6N 2 0, siqilgan asil gazlarning kristallangan o'ta sovutilgan suvga ta'siridan hosil bo'ladi. Bu gidratlar klatrat turiga mansub bo'lib, bunday birikmalar hosil bo'lganda valentlik bog'lanishlari paydo bo'lmaydi. Klatratlarning suv bilan hosil bo'lishi mavjudligi bilan ma'qullanadi kristall tuzilishi ko'plab bo'shliqlardan iborat muz.
Biroq, davomida so'nggi o'n yilliklar kripton, ksenon va radon boshqa elementlar va birinchi navbatda ftor bilan birlashishga qodir ekanligi aniqlandi. Shunday qilib,; ftoridlar asil gazlarning ftor bilan to'g'ridan-to'g'ri o'zaro ta'sirida (isitish yoki elektr razryadda) olinadi. KrF 2, XeF 2, KrF 4, XeF 4 va RnF 4 . Ularning barchasi oddiy sharoitda barqaror bo'lgan kristallardir. Ksenon hosilalari oksidlanish holatida ham +6 geksaftorid olingan; XeF 6 , XeO3 trioksidi, Xe(OH)b gidroksid. Oxirgi ikkita birikma kislotali xususiyatga ega; shuning uchun ishqorlar bilan reaksiyaga kirishib, tuzlar hosil qiladiksenon kislotasi, masalan: Xe0 3 + Ba(OH) 2 BaXe0 4 + H 2 0.
hosilalar; ksenon (VI) kuchli oksidlovchi moddalar. Biroq, undan ham kuchliroq oksidlovchi moddalar ta'sirida, ksenonning oksidlanish darajasi -4-8 bo'lgan birikmalarni olish mumkin. Ushbu birikmalardan oktaflorid ma'lum XeF 8, Xe0 4 tetroksid va oksoheksaflorid XeOF 6.
Kripton, ksenon va radonning asil gazlar guruhining birinchi a'zolariga nisbatan yuqori kimyoviy faolligi ularning atomlarining nisbatan past ionlanish potentsiallari bilan izohlanadi. Kripton, ksenon va radon uchun bu qiymatlar ba'zi boshqa elementlarning ionlanish potentsiallariga yaqin (masalan, azot atomining ionlanish potentsiali 14,53 ga teng). IN, xlor atomi 12,97 V).
Eng buyuk amaliy qo'llash Argon, neon va geliy topilgan.
Vodorod (lot. Hydrogenium),H, kimyoviy element, birinchi atom raqami bo'yicha Mendeleyev davriy tizimida; atom massasi 1,0079. Oddiy sharoitlarda vodorod gazdir; rangi, hidi va ta'mi yo'q.
Tarixiy ma'lumotlar.16-17-asrlar kimyogarlarining ishlarida kislotalar metallarga taʼsir qilganda yonuvchi gaz ajralib chiqishi haqida bir necha bor eslatib oʻtilgan. 1766-yilda G.Kavendish ajralib chiqqan gazni yig‘ib o‘rganib, uni “yonuvchi havo” deb atadi. Flogiston nazariyasi tarafdori bo'lgan Kavendish bu gazni sof flogiston deb hisoblagan. 1783 yilda A. Lavuazye suvni tahlil qilish va sintez qilish orqali uning tarkibining murakkabligini isbotladi va 1787 yilda "yonuvchi havo" ni yangi kimyoviy element (Vodorod) deb aniqladi va uni berdi. zamonaviy ism vodorod (yunoncha hydor - suv va gennao - men tug'aman), bu "suvni tug'ish" degan ma'noni anglatadi; bu ildiz Vodorod birikmalari va uning ishtirokidagi jarayonlar (masalan, gidridlar, gidrogenlash) nomlarida ishlatiladi. Zamonaviy ruscha "Vodorod" nomi 1824 yilda M. F. Solovyov tomonidan taklif qilingan.
Vodorodning tabiatda tarqalishi.Vodorod tabiatda keng tarqalgan, uning miqdori yer qobig'ida (litosfera va gidrosfera) massa bo'yicha 1% va atomlar soni bo'yicha 16% ni tashkil qiladi. Vodorod Yerdagi eng keng tarqalgan moddaning bir qismi - suv (massa bo'yicha vodorodning 11,19%), ko'mir, neft, tabiiy gazlar, gillar, shuningdek hayvon va o'simlik organizmlarini tashkil etuvchi birikmalar tarkibida (ya'ni oqsillar tarkibi, nuklein kislotalar , yog'lar, uglevodlar va boshqalar). Erkin holatda vodorod juda kam uchraydi kichik miqdorlar vulqon va boshqa tabiiy gazlarda uchraydi. Atmosferada erkin vodorodning oz miqdori (atomlar soni bo'yicha 0,0001%) mavjud. Erga yaqin fazoda protonlar oqimi ko'rinishidagi vodorod Yerning ichki ("proton") radiatsiya kamarini hosil qiladi. Kosmosda vodorod eng keng tarqalgan element hisoblanadi. Plazma shaklida u Quyosh va aksariyat yulduzlar massasining yarmini, yulduzlararo muhit va gazsimon tumanlik gazlarining asosiy qismini tashkil qiladi. Vodorod bir qator sayyoralar atmosferasida va kometalarda erkin H shaklida mavjud 2, metan CH 4, ammiak NH 3, suv H 2 O, CH, NH, OH, SiH, PH kabi radikallar protonlar oqimi shaklida, Vodorod Quyoshning korpuskulyar nurlanishining bir qismidir va kosmik nurlar.
Vodorodning izotoplari, atomi va molekulasi.Oddiy vodorod 2 ta barqaror izotop aralashmasidan iborat: engil vodorod yoki protiy ( 1 H) va og'ir vodorod yoki deyteriy ( 2 H yoki D). 1 atomga tabiiy vodorod birikmalarida 2 H o'rtacha 6800 atomni tashkil qiladi 1 H. Massa raqami 3 bo'lgan radioaktiv izotop o'ta og'ir vodorod yoki tritiy deb ataladi ( 3 H yoki T), yumshoq b-nurlanish va yarim yemirilish davri T½ = 12,262 yil. Tabiatda tritiy, masalan, kosmik nurlar neytronlari ta'sirida atmosfera azotidan hosil bo'ladi; atmosferada u ahamiyatsiz (4 10-15 Vodorod atomlarining umumiy sonidan %). O'ta beqaror izotop olingan 4 H. Izotoplarning massa sonlari 1 N, 2 N, 3 N va 4 H, 1, 2, 3 va 4 mos ravishda protiy atomining yadrosida faqat bitta proton, deyteriy - bitta proton va bitta neytron, tritiy - bitta proton va 2 neytron borligini ko'rsatadi. 4 H - bitta proton va 3 neytron. Vodorod izotoplari massalaridagi katta farq ularning fizik va kimyoviy xossalarida boshqa elementlarning izotoplariga qaraganda sezilarli farqni keltirib chiqaradi.
Vodorod atomi boshqa barcha elementlarning atomlari orasida eng oddiy tuzilishga ega: u yadro va bitta elektrondan iborat. Yadroga ega bo'lgan elektronning bog'lanish energiyasi (ionlanish potentsiali) 13,595 eV ga teng. Neytral vodorod atomi manfiy H ionini hosil qilib, ikkinchi elektronni ham qo'shishi mumkin- bu holda ikkinchi elektronning neytral atom bilan bog'lanish energiyasi (elektron yaqinligi) 0,78 eV ni tashkil qiladi. Kvant mexanikasi bizga vodorod atomining barcha mumkin bo'lgan energiya darajalarini hisoblash imkonini beradi va shuning uchun uning atom spektrining to'liq talqinini beradi. Vodorod atomi boshqa, murakkabroq atomlarning energiya darajalarining kvant mexanik hisoblarida namunaviy atom sifatida ishlatiladi.
Molekula vodorod H 2 kovalent bog' bilan bog'langan ikkita atomdan iborat kimyoviy bog'lanish. Dissotsilanish energiyasi (ya'ni atomlarga parchalanish) 4,776 eV ni tashkil qiladi. Yadrolarning muvozanat holatidagi atomlararo masofa 0,7414 Å. Yuqori haroratda molekulyar vodorod atomlarga ajraladi (2000 ° S da dissotsilanish darajasi 0,0013, 5000 ° S da 0,95). Atom vodorodi ham turlicha shakllanadi kimyoviy reaksiyalar(masalan, Zn ning xlorid kislotaga ta'siri). Biroq, vodorodning atom holatida mavjudligi faqat davom etadi qisqa vaqt, atomlar H molekulalariga qayta birlashadi 2 .
Vodorodning fizik xossalari.Vodorod barcha ma'lum bo'lgan moddalarning eng engili (havodan 14,4 marta engil), zichligi 0 ° C va 1 atm da 0,0899 g / l. Vodorod mos ravishda -252,8 ° S va -259,1 ° S da qaynaydi (suyuqlanadi) va eriydi (qattiqlashadi) (faqat geliyda ko'proq bo'ladi). past haroratlar erish va qaynatish). Vodorodning kritik harorati juda past (-240 ° C), shuning uchun uni suyultirish katta qiyinchiliklarga to'la; tanqidiy bosim 12,8 kgf / sm 2 (12,8 atm), kritik zichlik 0,0312 g/sm 3 . Barcha gazlar ichida vodorod eng yuqori issiqlik o'tkazuvchanligiga ega, 0°C va 1 atm da 0,174 Vt/(m K) ga teng, ya'ni 4,16 10-4 kal/(s·sm·°S). Vodorodning solishtirma issiqlik sig'imi 0 ° C va 1 atm S p 14,208 kJ / (kg K), ya'ni 3,394 kal / (g ° C). Vodorod suvda ozgina eriydi (20°C va 1 atm haroratda 0,0182 ml/g), lekin koʻpgina metallarda (Ni, Pt, Pa va boshqalar), ayniqsa palladiyda yaxshi eriydi (1 hajm Pd uchun 850 hajm). Vodorodning metallarda eruvchanligi ular orqali tarqalish qobiliyati bilan bog'liq; Uglerod qotishmasi (masalan, po'lat) orqali diffuziya, ba'zida vodorodning uglerod bilan o'zaro ta'siri (dekarbonizatsiya deb ataladigan) tufayli qotishmaning yo'q qilinishi bilan birga keladi. Suyuq vodorod juda yengil (zichligi -253°C 0,0708 g/sm. 3 ) va suyuqlik (qovushqoqligi -253 ° C 13,8 spoise).
Vodorodning kimyoviy xossalari.Ko'pgina birikmalarda vodorod natriy va boshqa gidroksidi metallar kabi valentlikni (aniqrog'i, oksidlanish darajasi) +1 ko'rsatadi; odatda davriy tizimning I guruhi sarlavhasi bo'lgan ushbu metallarning analogi sifatida qaraladi. Biroq, metall gidridlarda vodorod ioni manfiy zaryadlangan (oksidlanish darajasi -1), ya'ni Na gidrid+H- Na xlorid kabi qurilgan+ Cl - . Bu va boshqa ba'zi faktlar (yaqinlik jismoniy xususiyatlar Vodorod va galogenlar, galogenlarning organik birikmalardagi vodorodni almashtirish qobiliyati) vodorodni davriy sistemaning VII guruhiga ham kiritishga asos beradi. Oddiy sharoitlarda molekulyar vodorod nisbatan kam faol, to'g'ridan-to'g'ri faqat eng faol metall bo'lmaganlar bilan (ftor bilan va yorug'likda xlor bilan) birlashadi. Biroq, qizdirilganda, u ko'plab elementlar bilan reaksiyaga kirishadi. Atom vodorodi molekulyar vodorodga nisbatan kimyoviy faollikni oshirdi. Kislorod bilan vodorod suv hosil qiladi:
H 2 + 1/2 O 2 = H 2 O
285,937 kJ/mol, ya'ni 68,3174 kkal/mol issiqlik chiqishi bilan (25°C va 1 atm). At normal haroratlar reaktsiya juda sekin, 550 ° C dan yuqori - portlash bilan davom etadi. Vodorod-kislorod aralashmasining portlash chegaralari (hajmi bo'yicha) 4 dan 94% gacha H. 2 , va vodorod-havo aralashmasi - 4 dan 74% gacha H 2 (2 jildli aralashma H 2 va 1 jild O 2 portlovchi gaz deb ataladi). Vodorod ko'plab metallarni kamaytirish uchun ishlatiladi, chunki u kislorodni oksidlaridan chiqaradi:
CuO + H 2 = Cu + H 2 O,
Fe 3 O 4 + 4H 2 = 3Fe + 4H 2 O va boshqalar.
Galogenlar bilan vodorod galogen vodorod hosil qiladi, masalan:
H 2 + Cl 2 = 2HCl.
Shu bilan birga, Vodorod ftor bilan (qorong'u va - 252 ° S da ham) portlaydi, xlor va brom bilan faqat yoritilganda yoki qizdirilganda, yod bilan esa faqat qizdirilganda reaksiyaga kirishadi. Vodorod azot bilan reaksiyaga kirishib, ammiak hosil qiladi:
ZN 2 + N 2 = 2NH 3
faqat katalizatorda va yuqori harorat va bosimlarda. Vodorod qizdirilganda oltingugurt bilan kuchli reaksiyaga kirishadi:
H 2 + S = H 2 S (vodorod sulfidi),
selen va tellur bilan ancha qiyin. Vodorod katalizatorsiz sof uglerod bilan faqat yuqori haroratlarda reaksiyaga kirishishi mumkin:
2H 2 + C (amorf) = CH 4 (metan).
Vodorod to'g'ridan-to'g'ri ba'zi metallar (ishqoriy, ishqoriy tuproq va boshqalar) bilan reaksiyaga kirishib, gidridlarni hosil qiladi:
H 2 + 2Li = 2LiH.
Vodorodning uglerod oksidi (II) bilan reaksiyalari katta amaliy ahamiyatga ega bo'lib, ularda harorat, bosim va katalizatorga qarab turli xil organik birikmalar hosil bo'ladi, masalan, HCHO, CH. 3 U va boshqalar. To'yinmagan uglevodorodlar vodorod bilan reaksiyaga kirishib, to'yingan bo'ladi, masalan:
C n H 2n + H 2 = C n H 2n+2.
Vodorod va uning birikmalarining kimyodagi roli nihoyatda katta. Vodorod protik kislotalar deb ataladigan kislotali xususiyatlarini aniqlaydi. Vodorod ko'plab organik va noorganik birikmalarning xususiyatlariga hal qiluvchi ta'sir ko'rsatadigan ba'zi elementlar bilan vodorod aloqasini hosil qiladi.
Vodorod olish.Vodorodni sanoat ishlab chiqarish uchun asosiy xom ashyo turlari tabiiy yonuvchi gazlar, koks gazlari va neftni qayta ishlash gazlaridir. Vodorod suvdan elektroliz yo'li bilan ham olinadi (arzon elektr energiyasi bo'lgan joylarda). Tabiiy gazdan vodorod olishning eng muhim usullari uglevodorodlarning, asosan metanning suv bug'lari bilan katalitik o'zaro ta'siri (konversiya):
CH 4 + H 2 O = CO + ZN 2,
va uglevodorodlarning kislorod bilan to'liq oksidlanishi:
CH 4 + 1/2 O 2 = CO + 2H 2
Olingan uglerod oksidi (II) ham konversiyaga uchraydi:
CO + H 2 O = CO 2 + H 2.
Tabiiy gazdan ishlab chiqarilgan vodorod eng arzon hisoblanadi.
Vodorod koks gazi va neftni qayta ishlovchi gazlardan gaz aralashmasining qolgan qismlarini ajratib olish yo'li bilan ajratiladi, ular chuqur sovutish paytida Vodorodga qaraganda osonroq suyultiriladi. Suvni elektroliz qilish to'g'ridan-to'g'ri oqim bilan amalga oshiriladi, uni KOH yoki NaOH eritmasidan o'tkazadi (kislotalar po'lat uskunaning korroziyasini oldini olish uchun ishlatilmaydi). Laboratoriyalarda vodorod suvni elektroliz qilish, shuningdek, rux bilan reaksiya natijasida olinadi. xlorid kislotasi. Biroq, ko'pincha ular silindrlarda tayyor vodoroddan foydalanadilar.
Vodorodni qo'llash.Vodorod sanoat miqyosida 18-asrning oxirida to'ldirish uchun ishlab chiqarila boshlandi sharlar. Hozirgi vaqtda vodorod kimyo sanoatida, asosan, ammiak ishlab chiqarish uchun keng qo'llaniladi. Vodorodning asosiy iste'molchisi, shuningdek, metil va boshqa spirtlar, sintetik benzin va vodorod va uglerod oksidi (II) dan sintez qilingan boshqa mahsulotlar ishlab chiqarishdir. Vodorod qattiq va ogʻir suyuq yoqilgʻilarni, yogʻlarni va boshqalarni gidrogenlashda, HCl sintezida, neft mahsulotlarini gidrotozalashda, kislorod-vodorod alangasi bilan metallarni payvandlashda va kesishda (harorati 2800°C gacha) ishlatiladi. va atom-vodorodli payvandlashda (4000 ° S gacha). Vodorod izotoplari - deyteriy va tritiy - atom energiyasida juda muhim qo'llanilishini topdi.
Elementlarning kimyoviy xossalari 13-bet
Kimyo - kimyoviy elementlarni, ular hosil qiladigan oddiy va murakkab moddalarni (tarkibi, tuzilishi, xossalari), ularning o'zgarishi va bu o'zgarishlar bo'ysunadigan qonunlarni o'rganadigan fan. U noorganik, organik, fizik, analitik, kolloid va boshqalarga bo'linadi.Zamonaviy kimyo boshqa fanlar bilan bog'liq bo'lib, buning natijasida fanning chegaradosh sohalari: biokimyo, agrokimyo, kosmokimyo, radiokimyo va boshqalar vujudga keladi.Zamonaviy kimyo yutuqlari. stimuldir intensiv o'sish kimyo sanoati, o'yin muhim rol barcha tarmoqlarning ilmiy-texnikaviy taraqqiyotida milliy iqtisodiyot. Eng dolzarb va istiqbolli muammolarni hal qilishda kimyo muhim rol o'ynaydi zamonaviy jamiyat(qishloq xo'jaligi mahsulotlari hosildorligini oshirish uchun sun'iy o'g'itlarning samaradorligi va xavfsizligini oshirish va nooziq-ovqat xom ashyosidan oziq-ovqat mahsulotlarini sintez qilish muammosi; xom ashyoning okean manbalarini rivojlantirish; yangi energiya manbalarini ishlab chiqish va yaratish; yangi energiya manbalarini sintez qilish; kelajakdagi muammolarni hal qilish uchun zarur bo'lgan moddalar va kompozitsiyalar; muhit). Qarang: № 2, 334-bet.
Kimyo fanining o'rganish ob'ekti kimyoviy elementlar va ularning birikmalaridir. Kimyoviy element atomlar to'plamidir teng zaryad yadrolari. O'z navbatida, atom kimyoviy elementning barcha kimyoviy xossalarini saqlaydigan eng kichik zarrasidir. Shunday qilib, har bir kimyoviy element ma'lum turdagi atomga mos keladi. Qarang: № 3, 11-bet.
Molekula - mustaqil mavjud bo'lishga qodir bo'lgan, asosiy kimyoviy xususiyatlarga ega bo'lgan va bir xil yoki turli atomlardan tashkil topgan alohida moddaning eng kichik zarrasi. Molekulalar bir, ikki yoki ko'p atomli bo'lishi mumkin. Ular materiyaning tarkibiy zarralaridir. Agar molekulalar bir xil atomlardan iborat bo'lsa, u holda modda oddiy yoki elementar deyiladi, masalan, He, Ar, H2, O2, O3, S4, P4. Oddiy modda - bu kimyoviy elementning erkin holatda bo'lish shakli. Qarang: № 3, p11 p12.
Agar moddaning molekulasi turli atomlardan iborat bo'lsa, u holda bu modda kompleks (yoki kimyoviy birikma) deb ataladi, masalan, CO, H2O, NH3, H3PO4. Har qanday modda ma'lum tarkibi (uning molekulasidagi atomlarning tabiati va soni), tuzilishi (molekuladagi atomlarning fazoviy joylashishi) va ma'lum fizik-kimyoviy xossalari bilan tavsiflanadi. № 3, 12-betga qarang.
Moddaning kimyoviy xossalari uning kimyoviy reaktsiyalarda, ya'ni ba'zi moddalarni boshqalarga aylantirish jarayonlarida ishtirok etish qobiliyatini tavsiflaydi. Bu xususiyatlarni tushunish uchun moddalarning tarkibi va tuzilishini bilish kerak. № 3, 12-betga qarang.
Butun davriy jadvalni metallar, nometallar va amfoter moddalarga bo'lish mumkin. Metalllar- tashqi energiya darajasida (valentlik elektronlari) joylashgan elektronlarni berish va musbat zaryadlangan ionlarga aylantirish qobiliyati bilan tavsiflangan oddiy moddalar. Deyarli barcha metallar yuqori elektr va issiqlik o'tkazuvchanligiga, yorug'lik to'lqinlarini yaxshi aks ettirish qobiliyatiga (ularning yorqinligi va shaffofligini belgilaydi) va plastiklikka ega. Qattiq holatda ular odatda kristalli tuzilishga ega. Metalldagi atomlar orasidagi aloqa valentlik elektronlari orqali amalga oshiriladi, ular musbat zaryadlangan metall ionlari hosil qilgan kristall panjarada erkin harakatlanadi. Davriy sistemadagi 107 ta elementdan 83 tasi metallardir. Metalllarning ko'pgina ishlash xususiyatlari nafaqat ularning kimyoviy xossalariga, balki ishlab chiqarish va keyinchalik qayta ishlash usullari natijasida olingan tuzilishga ham bog'liq. Bu metallarning xossalarini keng o'zgartirish imkoniyatini yaratadi va ularni eng muhim konstruktiv, elektr, mexanik va boshqa materiallarga aylantiradi. Bugungi kunda metallar texnologiyaning turli sohalarida keng qo'llaniladi. Metall bo'lmaganlar- egiluvchan bo'lmagan oddiy moddalar; metall nashrida, issiqlik va elektr energiyasini yomon o'tkazuvchilardir. Metall bo'lmagan atomlar asosan elektronlarni biriktirish qobiliyati bilan tavsiflanadi, ya'ni. manfiy zaryadlangan ionlarga aylanadi. Nometalllarga 22 ta element kiradi: H, B, C, Si, N, P, As, O, S, Se, Te, galogenlar va asil gazlar. Metall bo'lmagan oksidlar kislotali tabiatga ega, ular kislorodli kislotalarga mos keladi; Amfoter moddalar- kislotali va asosli xususiyatlarni namoyon etishga moyil bo'lgan moddalar. Amfoter modda, masalan, kuchli asos bilan reaksiyaga kirishib, kislotali xususiyatga ega bo'lishi mumkin, shu bilan birga, kuchli kislota bilan reaksiyaga kirishadigan bir xil modda asosiy xususiyatni namoyon qilishi mumkin. Qarang: № 2, p273, p279, p225.
Keling, kimyoviy elementlarning davriy jadvalini ko'rib chiqaylik. U davriy qonun asosida yaratilgan. Jadval 7 ta davr va 8 ta guruhdan iborat.
Davrlar jadvalning gorizontal qatorlari bo'lib, ular katta va kichikga bo'linadi. Sovun davrlarida 2 ta element (1-davr) yoki 8 ta element (2 va 3-davrlar), katta davrlarda 18 ta element (4 va 5) yoki 32 ta element (6-davr) mavjud. 7-davr hali tugamadi. Har qanday davr tipik metalldan boshlanadi va odatdagi metall bo'lmagan va olijanob gaz bilan tugaydi. Qarang: № 1, p271.
Vertikal ustunlar elementlar guruhlari deb ataladi. Har bir guruh ikkita kichik guruhga bo'linadi: asosiy va ikkilamchi. Kichik guruh - bu kimyoviy analoglar bo'lgan elementlarning to'plami. Ko'pincha kichik guruhning elementlari mavjud eng yuqori daraja guruh raqamiga mos keladigan oksidlanish. Qarang: № 1, p271.
Asosiy kichik guruhlarda elementlarning kimyoviy xossalari juda katta farq qilishi mumkin
"Kimyo. 9-sinf." O.S. Gabrielyan (GDZ)
Kimyoviy elementlarning xususiyatlari. Mendeleyevning davriy qonuni
1-savol.
Mendeleyev davriy qonuni kimyoning asosiy qonunlaridan biridir. Hammasi haqida bahslashish mumkin zamonaviy kimyo ustiga qurilgan. U atomlar xossalarining ularning tuzilishiga bog'liqligini tushuntiradi, bu bog'liqlikni barcha elementlar uchun umumlashtiradi, ularni turli guruhlarga ajratadi, shuningdek, xususiyatlariga qarab tuzilishi va tuzilishiga qarab xususiyatlarini taxmin qiladi.
Tushuntirish, umumlashtiruvchi va bashorat qilish funktsiyalariga ega bo'lgan boshqa qonunlar ham mavjud. Masalan, energiyaning saqlanish qonuni, yorug'likning sinishi qonuni, Mendelning genetik qonuni, qonuni. universal tortishish va hokazo.
2-savol.
Davriy jadvalga asoslanib, biz energiya darajalarida (2 va 5) elektronlarning kerakli joylashuviga ega elementni topamiz. Bu element azot: N: 1s 2 2s 2 2p 3.
Bu element oddiy modda - N 2, azot hosil qiladi. Azotning vodorod birikmasi - NH 3, ammiak. Eng yuqori azot oksidi N2O5. Bu oksid kislotali oksidlarga tegishli, chunki suvda eriganida u kuchli bo'ladi azot kislotasi HNO3.
N 2 O 5 + H 2 O = 2HNO 3;
N 2 O 5 + BaO = Ba(OH) 2;
N 2 O 5 + Ba(OH) 2 = Ba(NO 3) 2 + H 2 O;
+5 (N +5) oksidlanish holatidagi azot kuchli oksidlovchi xususiyatlarga ega:
2N 2 O 5 + 5C = 2N 2 + 5CO 2.
3-savol.
Ilgari berilliy elementi noto'g'ri hisoblangan III guruh. Buning sababi berilliyning atom massasini noto'g'ri aniqlash edi (9 o'rniga u 13,5 ga teng deb hisoblangan). DI. Mendeleyev elementning kimyoviy xossalariga asoslanib berilliy II guruhga kiradi, degan fikrni ilgari surdi. Beriliyning xossalari magniy (Mg) va kaltsiy (Ca)nikiga juda o'xshash va alyuminiydan (Al) butunlay farq qiladi. Be ga qo'shni elementlar bo'lgan Li va B ning atom massalari mos ravishda 7 va 11 ga teng ekanligini bilgan D.I.Mendeleev berilliyning atom massasi 9 ga teng deb hisobladi.
4-savol.
Ca elektronlari ketma-ket taqsimlangan atomdir
2, 8, 8, 2 raqamlari.
Element № 7-N,
element № 8 - O.
Reaktsiya tenglamalari:
3Ca + N 2 = Ca 3 N 2,
2Ca + O 2 = 2CaO.
Reaktsiya mahsulotlari ionli bog'lanish turiga ega.
Azot va kislorod molekulyar tuzilishga ega kristall panjaralar, kaltsiy esa metall kristall panjaraga ega.
O'zaro ta'sir mahsulotlari - Ca 3 N 2 va CaO - ionli kristall panjara tuzilishiga ega.
5-savol.
N, P, As, Sb, Bi - metall xususiyatlarini mustahkamlash.
Guruhlarning metall xossalari kuchayadi.
6-savol.
Elementlar seriyasida: N, Mg, Al, Si, P, S, Cl - metall bo'lmagan xususiyatlarni mustahkamlash.
Elementlarning metall bo'lmagan xossalari davrlarda ortadi.
7-savol.
Cl 2 O 7, P 2 O 5, SiO 2, Al 2 O 3, MgO, Na 2 O - kislota xususiyatlarining pasayishi.
Kislota xossalari davrlarda ortadi.
HClO 4, H3PO 4, H 2 SO 4, Al(OH) 3, NaOH – kislota xossalarining pasayishi.
8-savol.
B 2 O 3, BeO, Li 2 O - asosiy xususiyatlarning oshishi.
B(OH) 3, Be(OH) 2, LiOH - asosiy xossalarning oshishi.
B(OH) 3 – kuchsiz kislota;
Be(OH) 2 - zaif asos;
LiOH kuchli asosdir.
9-savol.
Elementlarning davriy tizimi kimyoviy elementlarning munosabatlarini aks ettiradi. Elementning atom raqami yadro zaryadiga, son jihatdan esa protonlar soniga teng. Bir elementning yadrolaridagi neytronlar soni protonlar sonidan farqli o'laroq, har xil bo'lishi mumkin. Yadrolari mavjud bo'lgan bir elementning atomlari boshqa raqam neytronlarga izotoplar deyiladi.
Har bir kimyoviy element bir nechta izotoplarga ega (tabiiy yoki sun'iy ravishda olingan). Kimyoviy elementning atom massasi uning barcha tabiiy izotoplari massalarining ko'pligini hisobga olgan holda o'rtacha qiymatiga teng.
Izotoplar kashf etilishi bilan elementlarni davriy sistema boʻylab taqsimlashda ularning atom massalari emas, balki yadrolarning zaryadlari qoʻllanila boshlandi.
10-savol.
Bu elementlar va ularning birikmalarining xossalari elektronlarning umumiy soniga emas, balki faqat oxirgi qatlamda joylashgan valent elektronlar soniga bog'liq bo'lganligi sababli sodir bo'ladi. Valentlik elektronlari soni davriy ravishda o'zgarib turadi, shuning uchun elementlarning xususiyatlari ham davriy ravishda o'zgaradi.
11-savol.
1. Kimyoviy elementlarning xossalari va ular hosil qilgan moddalar davriy ravishda elementlarning nisbiy atom massalariga bog'liq.
2. Kimyoviy elementlarning xossalari va ular tomonidan hosil bo'ladigan moddalar davriy ravishda elementlarning atom yadrolarining zaryadiga bog'liq.














