Не смотря на то, что алюминий и его сплавы обладают хорошей коррозийной стойкостью, местные формы коррозии все же могут наблюдаться в некоторых случаях, при этом важным моментом является понимание факторов, которые способствуют их появлению.
Коррозию можно определить как реакцию, происходящую между металлом его непосредственным окружением, которое может иметь естественное или химическое происхождение. Наиболее известной формой коррозии считается ржавление железа. Все металлы обладают свойством вступать в реакцию с окружающей средой, отличие заключается лишь в ее интенсивности. Для благородных металлов, вроде золота, интенсивность реакции является незначительной, тогда как для железа напротив, степень реагирования весьма значительна. Алюминий в данном случае не является исключением, однако, к счастью, он так же обладает склонностью к самопассивации, поэтому в большинстве случаев это не становится проблемой.
Существует 2 основных фактора, которые имеют влияние на общее протекание процесса коррозии алюминия. Одним из них является агрессивность окружающей среды, вторым – химическая и металлургическая структура. Окружающая среда может быть различной – от простой атмосферы до некой среды, типа почвы, воды, строительных материалов, пищи и химикатов. Наружная атмосфера обычно классифицируется как сельская, промышленная или приморская, в зависимости от географического расположения. В сельской атмосфере уровень естественного загрязнения весьма низок, промышленная и приморская атмосфера более агрессивна, чаще всего вследствие присутствия в ней соответственно сульфатов и хлоридов. Почвы, вода и строительные материалы так же отличаются по своей агрессивности, в зависимости от таких их свойств, как состав, химическая активность, интенсивность аэрации и электропроводимость. Химическая среда, как правило, имеет уникальный состав, поэтому коррозийный эффект может быть определен достаточно точно.
Чистый алюминий имеет наибольшую коррозийную стойкость, однако с уменьшением его чистоты путем добавления легирующих элементов стойкость уменьшается. Больше всего коррозийную стойкость уменьшает медь, а меньше всего – магний. Эффект, оказываемый основными используемыми легирующими элементами на коррозийную стойкость алюминия, отображен в таблице
Общий эффект, оказываемый основными легирующими элементами на коррозийную стойкость алюминия.
| Элемент | Эффект | |||
|
Умеренный |
Очень слабый |
|||
| Цинк | x | |||
|
Марганец |
||||
|
Цирконий |
||||
|
Железо+кремний |
||||
Металлургическое состояние алюминиевого сплава для некого состава определяется историей его производства. Деформированный сплав может быть получен либо путем нагартовывания, либо путем тепловой обработки раствора. Сплавы алюминия так же могут существовать в литой форме. Короче говоря, деформационное упрочнение означает деформацию при комнатной или немного большей температуре, а для полуфабрикатов используется прокатка. Основным признаком прокатки является смещение в матрицах, варьирующихся от субзерен с рваными границами, до высокоплотных конфигураций «лесов» и линий скольжения. Холодные структуры так же образуются в результате таких процессов, как резка, штамповка и формовка. Двумя основными группами нагартовывающихся сплавов являются сплавы на основе Al-Mn (серия 3000) и Al-Mg (серия 5000).
В общем, тепловая обработка электролитом состоит из двух основных этапов. Первый включает выдержку в нагревательной печи при температурах от 450°C до 550°C в течение заранее определенных промежутков времени, зависящих от данного состава сплава, за которой следует закалка в воде или на воздухе, опять же в зависимости от сплава. Вторым этапом является дисперсионное твердение, выполняемое при температурах от 20°C до приблизительно 175°C. В течении 1-ого этапа большинство из элементов сплава помещаются в твердый раствор, а затем частично освобождаются от этого состояния в процессе дисперсионного твердения. Если речь идет не о межзеренной границе или о каком-либо другом энергетический благоприятном регионе, то освобожденный из твердого раствора материал сохраняет сцепку с матрицей и таким образом увеличивает свою прочность. В случае продления периода дисперсионного твердения или повышения температуры наблюдается тенденция к разрушению сцепления и уменьшению прочности материала. На границах зерен процесс дисперсионного твердения зачастую более сложен, чем в остальных областях, а не сцепленные частицы находятся в фазе упрочнения. Выделение (вторичных фаз) по границам зёрен. Основными сплавами, подвергающимися температурной обработке, являются сплавы, основанные на Al-Cu (ряд 2000), Al-Mg-Si (ряд 6000), Al-Zn-Mg и Al-Zn-Mg-Cu (ряд 7000).
Несмотря на существование достаточно большого количества литейных сплавов, большинство из них все же приобретают свои свойства благодаря добавлению магния, кремния и меди, по отдельности или в комбинации. Количество магния может варьироваться в диапазоне от 3 до 11 %, для кремния это значение составляет от 3 до 13 %, а для меди – от 1 до 5%. Они производятся с легирующими добавками от «литых» до «тепловой обработки в растворе» в зависимости от состава сплава. Их основной структурой является структура дендритических клеток в алюминиевой матрице. Некоторые из изменений основной структуры имеют место благодаря тепловой обработке.
Алюминий – широко распространенный в промышленности и быту металл. Окисление алюминия на воздухе не происходит. Его инертность обусловлена тонкой оксидной пленкой, защищающей его. Однако под влиянием определенных факторов из окружающей среды этот метал все же подвергается разрушительным процессам, и коррозия алюминия — не такое уж и редкое явление.
Виды коррозии
Окисляется алюминий в атмосфере быстро, но на небольшую глубину. Этому препятствует защитная окисная пленка. Окисление ускоряется выше температуры плавления алюминия. Если нарушается целостность оксидной пленки, алюминий начинает корродировать. Причинами истончения его защитного слоя могут стать различные факторы, начиная с воздействия кислот, щелочей и заканчивая механическим повреждением.
Коррозия алюминия – саморазрушение металла под воздействием окружающей среды. По механизму протекания выделяют:
- Химическую коррозию – происходит в газовой среде без участия воды.

- Электрохимическую коррозию – протекает во влажных средах.

- Газовое разрушение – но сопровождает нагрев и горячую обработку алюминия. В результате взаимодействия кислорода с металлами возникает плотная окисная пленка. Вот почему алюминий не ржавеет, как и все цветные металлы.

На видео: электрохимическая коррозия металлов и способы защиты.
Причины коррозии алюминия
Коррозионная стойкость алюминия зависит от нескольких факторов:
- чистоты – наличия примесей в металле;
- воздействующей среды – алюминий может одинаково подвергаться разрушению и на чистом сельском воздухе и в промышленно загрязненных районах;
- температуры.
Во многих случаях малоконцентрированные кислоты могут растворить алюминий. От возникновения коррозии не защищает естественная окисная пленка.
Мощные разрушители – фтор, калий, натрий. Алюминий и его сплавы корродируют при воздействии химических соединений брома и хлора, растворов извести и цемента.

Коррозия алюминия и его сплавов происходит в воде, воздухе, оксидах углерода и серы, растворах солей. Морская вода приводит к ускоренному разрушению. Алюминий считается активным металлом, но при этом отличается хорошими коррозионными свойствами.
Выделяют два основных фактора, которые влияют на интенсивность коррозийного процесса:
- степень агрессивности воздействующей окружающей среды – влажность, загрязненность, задымленность;
- химическая структура.
Алюминий не подвергается коррозии в чистой воде. Не влияют на защитную оксидную пленку нагревание и пар.
Проявление коррозии алюминия
Выделяют следующие виды коррозии алюминия и его сплавов:
- Поверхностная – наиболее распространенная, приносит наименьший вред, легко заметна и быстро поддается устранению.
- Локальная – разрушения наблюдаются в виде углублений и пятен. Опасный вид коррозии в силу своей незаметности. Встречается в труднодоступных частях и узлах металлических конструкций.
- Нитеподобная, филигрань – наблюдается под покрытиями из органики, на ослабленных местах поверхности.
Любой из видов коррозии конструкций из алюминия является причиной разрушения.

Это сокращает срок эксплуатации изделий. В гальванической паре алюминий может корродировать, при этом он защищает другой металл.
Естественных антикоррозийных свойств алюминия и его сплавов недостаточно. Поэтому механизмы, агрегаты, конструкции и изделия из металла нуждаются в дополнительной защите.
Способы борьбы с коррозией
Защита от коррозии производится несколькими способами:
- Механическое лакокрасочное защитное покрытие.
- Электрохимическая защита – покрытие более активными металлами;
- Покрытие алюминия порошковыми составами, так называемый процесс аллюминирования;
- Высоковольтное анодирование;
- Химическое оксидирование;
- Применение ингибиторов коррозии.

Механическое покрытие
Как защитить алюминий от коррозии? Чаще всего применяют механический способ – нанесение слоя краски.

Покройте краской изделие и вы убедитесь в действенности этого способа. Окрашивание бывает мокрым и сухим, или порошковым. Эти технологии усовершенствуются. При мокром окрашивании лакокрасочные слои наносят после защиты алюминия составом, содержащим соединения цинка и стронция. Металлическую основу тщательно подготавливают: защищают, шлифуют, сушат. Грунт наносят поэтапно.

Когда растворитель из грунтовочной смеси полностью исчезнет, поверхность можно покрывать изолирующим составом: масляным или глифталиевым лаком.

Специальные составы помогают остановить коррозию и защищают алюминиевые конструкции от химикатов, бензина, различного вида масел. Выбор покрытия зависит от условий последующей эксплуатации металлического изделия:
- молотковые – применяют для получения конструкций различных цветовых оттенков, используемых в декоре;
- бакелитовые – наносят под высоким давлением, заполняя микротрещины и поры.
Порошковое окрашивание требует тщательной очистки поверхности от жира и различных отложений. Это достигается погружением в щелочные или кислотные растворы с добавлением смачивателей. Далее на алюминиевые конструкции наносится слой хроматных, фосфатных, циркониевых или титановых соединений. После этого он не будет окисляться.
После просушки материала на окислившийся участок наносят защитный полимер. Чаще всего используются полиэфиры, стойкие к механическому, химическому и термическому воздействию. Применяют полимеризованный уретан, эпоксидные и акриловые порошки.
Оксидирование алюминия
Оксидирование алюминия протекает при постоянном токе под напряжением 250 В. Наращивание защитной пленки происходит при комнатной температуре с водяным охлаждением. Не требуется импульсного источника. Пленки получаются плотными и прочными в течение 45-60 минут.
На плотность и цвет оксидного покрытия влияет температура электролита:
- пониженная температура образует плотную пленку яркого цвета;
- повышенная – формирует рыхлую пленку, требующую дальнейшей окраски.
Образовать защиту алюминия от коррозии можно электрохимической реакцией. Процесс разделен на несколько этапов:
1. На стадии подготовки алюминиевое изделие обезжиривают, погружая его в раствор щавелевой кислоты.
2. После промывания водой опускают в щелочной раствор, чтобы удалить неравномерно образовавшийся оксидный слой.
3. Для дополнительной окраски алюминиевые изделия погружают в соответствующие растворы солей. Чтобы заполнить образовавшиеся поры, металлический материал обрабатывают паром.

4. Затем изделие подвергают сушке. Анодное оксидирование может проводиться с применением переменного тока.
Для защиты от коррозии применяют химическое оксидирование – менее затратное, не требующее специального электрического оборудования и квалификации исполнителей. Используется несложный химический состав.
В процессе алюминирования полученная оксидная пленка толщиной в 3 мкм имеет салатный цвет, обладает высокими электроизоляционными свойствами, не пориста, не окрашивается.
Коррозия алюминия возникает вследствие находящихся рядом металлов, которые окислились. Предотвращению этот процесса способствует изоляция. Это могут быть прокладки из резины, битума, паронита. При покрытии ржавчиной применяются лак и другие изолирующие материалы. Других способов избавиться от этой проблемы пока нет.
Три способа удалить окисную плёнку с поверхности алюминия (1 видео)
1. Коррозия алюминия
1.1. Введение
Во-первых, следует сказать, что сопротивляемость алюминия и алюминиевых сплавов к обычной внешней коррозии разная. Естественное сопротивление коррозии одна из причин такой широкой применяемости алюминиевых сплавов от производства консервных банок до использования в архитектуре и самолетостроении. Основной источник защиты от коррозии – самовосстанавливающаяся оксидная пленка, постоянно существующей во внешней атмосфере.
Несмотря на химическую активность алюминия, оксидная пленка, образующаяся на его поверхности, инертна, и защищает поверхность от дальнейшего окисления. Толщина оксидной пленки на только что раскатанном листе алюминия 2,5 нм и за несколько лет ее толщина может достигнуть 10-20 нм (1 нм = 10-9м)
Коррозия в ее различных проявлениях возникает лишь в случае разрушения естественной оксидной пленки.
Следует запомнить две вещи о коррозии:
Она может привести к затратам
Деталь может потерять свои эксплуатационные качества. Следовательно, необходимо понимать при каких условиях может возникнуть коррозия и как ее предотвратить.
1.2. Виды коррозии
Существует много видов коррозии. Наиболее распространенные разновидности, встречающиеся в производстве и обслуживании:
(а) Равномерная коррозия
(b) Щелевая коррозия
© Коррозия под покрытием
(d) Фреттинг коррозия
(е) Коррозия под нагрузкой
Электрохимическая коррозия
(g) Точечная коррозия
Межкристаллическая коррозия и отслаивание
(а) Сплошная коррозия
Оксидная пленка растворяется под воздействием сильных щелочных и отдельных кислотных растворов. Например, сильное воздействие оказывает концентрированный раствор гидроксида натрия (каустической соды) и разбавленная азотная кислота. (b) Щелевая коррозия
Это явление называется водяными пятнами. Существует два основных условия вызывающих щелевую коррозию:
Во-первых, металлические листы или листовые элементы, спрессованные в пакеты, образуют щели, в которые будет появляться коррозия.
Во-вторых, в качестве активного ингредиента требуется влажность, вызываемая дождем или конденсатом. Понятно, что коррозия от дождя может появиться в ряде случаев, например при обработке, во время транспортировки, во время эксплуатации.
Щелевая коррозия является поверхностной коррозией и редко губительна для самого металла. Ее можно избежать, протирая куском ткани или, в ряде случаев, применяя абразивную обработку. Коррозия под покрытием.
Это происходит при контакте с влажной сырой субстанцией. В субстанции могут находиться химические вещества, которые усиливают воздействие. Обычно это проблемы заказчика вследствие либо плохого проекта, либо эксплуатации. (d) Фреттинг коррозия (фрикционная коррозия)
Фреттинг коррозию можно узнать по черным пятнам на поверхности металла под которыми могут находится глубокие язвы. Фреттинг коррозия вызывается трением двух алюминиевых деталей между собой. Выступы сцепляются между собой и затем отламываются. Окись алюминия это мелкий порошок черного цвета. (e) Коррозия под напряжением
Существует три существенных условия, которые приводят к растрескиванию от коррозии под нагрузкой:
Нагрузки (напряжения)
чувствительная к коррозии структура сплава
подходящая среда
Отсутствие любого из вышеперечисленных условий предотвращает коррозионное растрескивание. Электрохимическая коррозия
Электрохимическая коррозия проявляется в том случае, если алюминиевый сплав находится в контакте с другим металлом и влагой. Например, алюминий при влажном контакте с медью приводит к быстрой коррозии. Алюминий его сплавы электроотрицательны по сравнению со многими другими металлическими сплавами, применяемыми в технике. Это можно увидеть, сравнивая электродные потенциалы.
Эта таблица распределяет термодинамическую реактивную способность металлов согласно напряжению на электродах, измеренному относительно 0.1 каломельного электрода (Hg-HgCl2, 0.1 M KCl). При этом выбранные металлы и сплавы погружают в водный раствор 1 М (молярная масса) NaCl и 0.1 M H2O2.
Разность электродных потенциалов хотя и важна, но является не единственным критерием, определяющим опасность коррозии. Не менее важны электрическое сопротивление и поляризация гальванической цепи, т.е. тип электролита и формируемой окисной пленки. Например, несмотря на большую разницу потенциалов, электрохимическая коррозия между алюминием и нержавеющей сталью будет меньше чем ожидаемая, в то время как коррозия между алюминием и медью будет намного сильнее, несмотря на меньшую разность потенциалов. Это происходит благодаря прочной пассивной пленке на нержавеющей стали, которая вносит значительное электрическое сопротивление в гальваническую цепь для пары алюминий/нержавеющая сталь. (g) Точечная коррозия
Точечная коррозия это локальная электрохимическая коррозия, возникающая при появлении в основном сплаве инородных вкраплений, или участков с другим составом, чей электрохимический потенциал отличается от основного. Точечный ток приводит к образованию полупроницаемой гидроксидной шапки закрывающую язву, позволяя тем самым концентрироваться кислотному хлоридному раствору. Потенциал коррозии усиливается от кислородного обеднения внутри язвы и гальваническими парами между алюминием (анод) и вкраплениями, а также отложениями, (например Cu) которые являются катодами. Окружающая естественная окисная пленка с катодной защитой (щелочное пассивирование). Межкристаллическая коррозия и отслаивание. Обычно благодаря оксидной пленке твердые растворы алюминия устойчивы к равномерной коррозии. Неоднородность состава часто является причиной локальной коррозии на уровне микроструктур. Крупные осадочные частицы и дисперсные частицы примеси могут привести к точечной коррозии. Если эти частицы расположены на границах зерен, то такое локальное воздействие проявляется в виде межкристаллической коррозии и распространяется вглубь металла по границам зерен. В прокатном листе алюминия зерна вытянуты по направлению проката. Сильная межкристаллическая коррозия может привести к отслоению материала с поверхности листа.
2. Электрохимия и Алюминий
2.1. Введение
Как уже упоминалось раньше, алюминий легко связывается с кислородом. Оксид алюминия обладает большой теплотой образования. Поэтому алюминий стал поздно использоваться в промышленных целях. Алюминий обладает высокой электрохимической активностью. Обычная алюминиевая руда, боксит – это оксид Al2O3, соединения алюминия содержат химически окисленные элементы (ион Al +3) и поэтому более устойчивые, чем металл (алюминий). Тенденция металлов образовывать ионы при стандартных химических условиях представлена ряде электродных потенциалов. Этот ряд определяет степень термодинамической реакционной способности в соответствии с напряжением на электродах, измеренным относительно 0.1 каломельного электрода (Hg-HgCl2, 0.1 M KCl). При этом выбранные металлы и сплавы погружают в водный раствор 1 М (молярная масса) NaCl и 0.1 M H2O2. Для чистого алюминия эта величина равна -0.85, в то время как у алюминиевых сплавов напряжение колеблется в пределах от -0.69 до -0.99 .
У атомов алюминия три валентных электрона, отсюда:
Al -> Al3+ + 3 e-
Где e- – отрицательно заряженный электрон.
Ряд электродных потенциалов может быть получен на основании «стандартных электродных потенциалов» взятых относительно реакционной способности водорода, например:
H2 -> 2H + + 2 e-
Металлы, образующие катионы активнее водорода (m n+), называют «неблагородными» в отличие от более устойчивых металлов, как например золота, меди и серебра, которые принято называть «благородными». Неблагородные металлы, включая алюминий, спонтанно замещают водород в молекуле воды, к примеру
2Al + 3H2O -> Al2O3 + 3H2
Алюминий – менее благородный металл, чем железо или цинк, но более благородный, т.е. более стабильный, чем магний. При производстве сплавов алюминия получают фазы с различным химическими составами, которые могут быть более или менее активными, чем чистый алюминий. Отсюда получается электрохимически неоднородный сплав. Это свойство очень ценится. Более того, в различных химических средах, позиция металлов в ряде электродных потенциалов может меняться. Так, алюминий более активен в сильно щелочной, чем в кислотной среде.
2.2. Кинетическая реактивность (реакционная способность).
В реальности термодинамическая реактивность металлов часто неочевидна. Это происходит либо из-за того, что реакции протекают вяло, либо из-за того, что последствия реакции мешают ее протеканию. Для алюминия принципиальные продукты реакции – нерастворимые оксиды и гидроксиды. Они образуются на поверхности алюминия и обеспечивают эффективную защиту от постоянного износа металла. Такие продукты будут устойчивы при предсказуемых химических и электрохимических условиях.
2.3. Электрохимическая цепь
В случае возможности начала реакции Al -> Al3+ + 3 e- ионы алюминия покидают металл, в который удерживает электроны и тем самым заряжается отрицательно. Для того, чтобы реакция продолжалась этот заряд должен найти «потребителя» и ионы алюминия Al3+ также должны покинуть зону металла. Поскольку мы имеем дело с электрохимическим процессом, алюминий именуется «электродом»; и т.к. он окисляется, то является «анодом», т.е.
Al -> Al3+ + 3 e- является «анодным процессом»
Поглощение высвобожденного заряда электрона это эквивалент электрохимического восстановления, или «катодного» электродного процесса, например:
2H + + 2 e- -> H2
Или O2 + 2 H2O + 4 e- -> 4OH –
На практике, много катодных реакций происходит со стороны цельного алюминия либо сплава который также поддерживает анодный процесс. Это локальный процесс. Иногда неблагородный металл, такой как алюминий, может быть в электрическом контакте с менее благородным металлом (с меньшим электродным потенциалом) в электрохимически активной среде («электролит»). Тогда неблагородный металл, алюминий, будет коррозировать, а менее благородный поддерживать катодную реакцию. Такой процесс образует гальваническую ячейку.
Необходимыми составными частыми ячейки являются: (1) анод, (2) катод, (3) электропроводность (электронная и ионная).
2.4. Алюминий как катод
Одним из важных примеров использования алюминия в качестве катода можно встретить в электролитическом извлечении (обогащении) металла. Окись алюминия (боксит) расплавляют с криолитом (Na3 AlF6) до состояния расплавленного электролита. Затем его подвергают электролизу при помощи угольных анодов, на которых выделяется кислород:
В криолите эта реакция выглядит таким образом
Al2 O3 -> 2 Al 3+ + 3O 2 –
Соответствующий катодный процесс
Al 3+ + 3 e- -> Al
Анодный процесс
2O 2 – -> O2 + 4 e-
2.5. Алюминий как анод
Действие алюминия как катода сдерживается присутствием на его поверхности твердого окисного вещества. Эта окись ограничивает коррозию и часто определяет ее вид.
Когда только что изготовленный алюминий вступает в контакт с атмосферой, он немедленно покрывается тонкой окисной пленкой, которая преобразуется при локальных повреждениях. Первоначальная пленка аморфна и имеет различную степень гидратации. Восстановление вызывает гальваническую реакцию, в которой окисленная поверхность поддерживает катодный процесс, а на анодной стороне повреждения образуется новый оксид или гидроксид. Для того чтобы увеличить толщину и повысить защитные свойства оксидной пленки, могут проводиться специальные обработки – см. Анодирование и Конверсионное покрытие ниже.
2.5.1. Кратко о коррозии в электролитах
Этот вид коррозии требует наличия следующих компонентов: анода, катода, электронной и ионной проводимости. Существенным фактором является пространственное разделение электродов. На металлах, защищенных оксидной пленкой возможна критическая ситуация когда небольшие по размерам аноды смещаются большими соседними катодами. Незначительной неоднородности достаточно для локализации анодов. Возможные неоднородности возникают из-за состава металла, локальных напряжений (статических или циклических) и т.д., а также вследствие неравномерностей в электролите (например концентрации кислорода) или локальных агрессивных примесей.
3. Коррозионная защита
3.1. Анодирование
У ряда электролитов, таких как разбавленная серная кислота, хромовая, щавелевая и фосфорная кислота, продукты реакции на алюминиевых анодах плохо растворимы и хорошо пристают к поверхности.
При анодировании, анодная оксидная пленка состоит из двух слоев:
Внутреннего, плотного и тонкого слоя-барьера
и внешней пористой пленки, часто имеющей сотовую структуру
Внешний слой образуется электролитом из внутреннего слоя, и его толщина зависит от напряжения на аноде. Сформировавшись, внешний слой одновременно является и водным, и гидроксилированным, в основном аморфен. При погружении в кипящую деионнизированную воду на 30 минут анодная пленка кристаллизуется в устойчивый минерал – боэмит (алюминиевая руда) Al2O3.H2O. Этот процесс называется уплотнением (герметизацией). На практике различные процедуры анодирования применяются для придания поверхности металлических изделий определенных качеств. Например, при анодировании в холодной разбавленной кислоте мы получаем твердую, прочную поверхность. При использовании более концентрированного раствора кислоты пленка будет более толстой и однородной, пригодной для покраски перед уплотнением.
3.1.1. Химические конверсионные покрытия
Можно легко достичь окисления поверхности алюминия при помощи химических оксидантов без внешней подачи тока. Однако такие процессы имеют электрохимическую природу, предполагающие локальные гальванические ячейки. Они известны как химические конверсионные покрытия. Пример с хромовой кислотой:
Анодная реакция Al - > Al 3+ + 3е- -> Al2O3 и AlO.OH
Катодная реакция 2CrO42- + 10H + + 6е- -> Cr2O3 + 5H2O
В данном случае для замещения исходного Al2O3 и протекания реакций в локальных гальванических ячейках к хромовой кислоте добавляют флюориды. В случае с фосфорной кислотой анодным продуктом является фосфат алюминия.
На сегодняшний день конверсионные покрытия широко конкурируют с анодированием, т.к. они обеспечивают экономически выгодные основы для современных органических покрытий.
3.1.2. Другие методы защиты
Воздействие щелочей, даже в виде мыла, может быть очень сильным. В качестве конверсионных покрытий для защиты сплавов алюминия, используемых, скажем, в стиральных машинах, применяют ингибиторы, такие как силикат натрия, хроматы и дихроматы. Листовая продукция может быть покрыта, например, чистым алюминием, повышая сопротивляемость к коррозии.
Алюминий и, в разной степени, его сплавы обладают высокой стойкостью к коррозии даже без какого-либо специального защитного покрытия.
Естественная поверхность алюминия, которая возникает в ходе изготовления алюминиевого изделия, например, прессованием, прокаткой или литьем, имеет высокое сопротивление коррозии в большинстве типов окружающей среды. Это происходит потому, что свежая поверхность алюминия спонтанно и мгновенно образует тонкий, но очень эффективный оксидный слой, который предотвращает дальнейшее окисление металла.
Эта оксидная пленка является непроницаемой и, в отличие от оксидных пленок других металлов, например, железа, очень прочно «прикрепляется» к основному металлу. При каком-либо механическом повреждении эта пленка мгновенно восстанавливается, залечивается.
Естественный оксидный слой и является главной причиной хорошего сопротивления алюминия к коррозии. Это покрытие является стойким в средах с кислотностью – водородным показателем рН – от 4 до 9.
Три главных вида коррозии алюминия
Наиболее частыми видами коррозии алюминия являются:
- гальваническая коррозия;
- язвенная коррозия;
- щелевая коррозия.
Коррозия под напряжением, которая ведет к образованию трещин, является более специфическим видом коррозии. Она случается в основном в высокопрочных алюминиевых сплавах, например, сплавах AlZnMg, когда они подвергаются длительным растягивающим напряжениям в присутствии коррозионной среды. Этот тип коррозии обычно не происходит в сплавах серии 6ххх, то есть сплавах AlMgSi.
Гальваническая коррозия алюминия
Гальваническая коррозия может случаться тогда, когда два различных металла находятся в непосредственном контакте и между ними образовался электролитический мост. Менее благородный металл в этой комбинации становится анодом и корродирует. Более благородный металл становиться катодом и находится под защитой от коррозии.
В большинстве комбинаций с другими металлами алюминий является менее благородным металлом. Поэтому алюминий подвержен более высокому риску гальванической коррозии, чем другие строительные материалы. Однако, этот риск меньше, чем это обычно считается.
Необходимые условия: контакт и влага
Гальваническая коррозия алюминия происходит только тогда, когда одновременно:
- есть контакт с более благородным металлом (или другим электрическим проводником с более высоким химическим потенциалом, чем у алюминия, например, графитом;
- между двумя металлами находится электролит с хорошей проводимостью, чаще всего, вода с растворенными солями.
Гальваническая коррозия не происходит в сухой воздушной атмосфере, например, внутри нормального жилого помещения. Нет большого риска гальванической коррозии и чистой сельской атмосфере. Вместе с тем, риск гальванической коррозии необходимо всегда принимать в расчет в атмосферах с высоким содержанием хлоридов, например, в районах вблизи морей и океанов.
Алюминий и оцинкованная сталь
Могут быть проблемы с гальванической коррозией и в паре алюминия с оцинкованной сталью. Цинковое покрытие оцинкованной стали будет сначала защищать алюминий от коррозии. Однако, эта защита снижается, когда поверхность стали начинает обнажаться по мере расходования цинка. Горячее цинкование стали дает большую толщину цинкового покрытия, чем электрохимическое цинкование и обеспечивает более длительную защиту алюминия. Поэтому в агрессивной атмосфере в контакте с алюминием применяют только оцинкованную сталь горячего цинкования.
Электрическая изоляция
Там, где различные металлы применяются в контакте, гальванической коррозии можно избежать путем электрической изоляции одного металла от другого. Пример такого решения для болтового соединения между алюминиевым и стальным листом приведен на рисунке 1. Между головкой болта и поверхностью алюминия может возникнуть электролит, но электроизолирующая шайба не даст возможности протекать гальваническому электрическому току и коррозии не произойдет. С другой стороны в контакте алюминиевого и стального листа отсутствует возможность попадания влаги, электролит не образуется и коррозия не происходит.
Рисунок 1 – Электрическая изоляция алюминия от стали
Разрыв электролитической цепи
В больших конструкциях, там, где применение электроизоляции затруднительно, применяют альтернативное решение – предотвращение электролитического мостика между двумя металлами. Окраска поверхности – это один из путей сделать это. Чаще всего лучшим вариантом является окраска поверхности катода, то есть более благородного металла.
Катодная защита
Катодная защита от коррозии может достигаться двумя путями. Чаще всего – это установка анода из менее благородного металла в прямом металлическом контакте с алюминием. Этот менее благородный металл «жертвует» собой, то есть корродирует вместо алюминия. Поэтому его называют жертвенным анодом.
Чтобы такой жертвенный анод работал, он должен быть в жидком контакте с защищаемой алюминиевой поверхностью. Для защиты алюминия в качестве жертвенных анодов чаще всего применяют цинк и магний. Пример катодной защиты показан на рисунке 2.
Другим путем получения катодной защиты является подсоединение алюминиевого объекта к отрицательному полюсу выпрямителя тока.
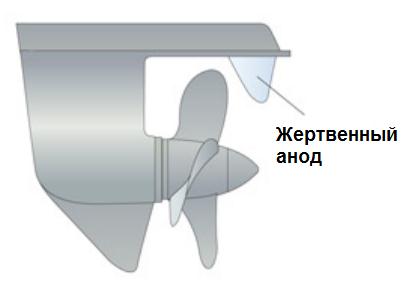 Рисунок 2 – Катодная защита алюминиевого винта судна
Рисунок 2 – Катодная защита алюминиевого винта судна
Язвенная коррозия алюминия
Для алюминия именно язвенная коррозия является наиболее частым видом коррозии. Она также случается только в присутствии электролита (воды или влаги), который содержит растворенные соли, обычно хлориды.
Эта коррозия обычно выглядит как очень маленькие ямки, которые на открытом воздухе достигают максимальной глубины незначительной части толщины металла. Глубина этих ямок может быть больше в воде и почве.
Предотвращение язвенной коррозии
Язвенная коррозия является в основном вопросом эстетическим, потому что, в практическом смысле, никогда не снижает прочности алюминиевых изделий.
Проявление язвенной коррозии, конечно, бывает более серьезным на алюминии с естественной поверхностью, то есть поверхностью без какой-либо защитной обработки. Защитная обработка поверхности алюминия (анодирование, окраска или другие методы нанесения покрытий) успешно защищает его от язвенной коррозии.
Для предотвращения язвенной коррозии применяют также катодную защиту (см. выше).
Конструирование дренажа
Очень важно проектировать алюминиевые профили и другие алюминиевые изделия так, что они имели возможность дренажа осадков и быстрого высыхания поверхности. Профили, которые могут подвергаться воздействию влаги, не должны иметь углов или карманов, в которых скапливается вода. Каждый профиль, в котором может скапливаться вода, должен иметь дренажные отверстия (рисунок 3).
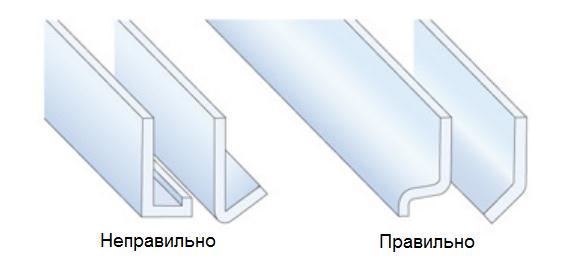 Рисунок 3 – Конструктивный дренаж в алюминиевых профилях
Рисунок 3 – Конструктивный дренаж в алюминиевых профилях
Эффективный дренаж (рисунок 4) и вентилирование «мокрых» алюминиевых профилей значительно снижает риск появления на них язвенной коррозии.
 Рисунок 4 – Дренажные отверстия в алюминиевом профиле
Рисунок 4 – Дренажные отверстия в алюминиевом профиле
Щелевая коррозия алюминия
Сущность щелевой коррозии
Щелевая коррозия может возникать в узких, наполненных жидкостью щелях. Возникновение такой коррозии в алюминиевых профилях маловероятно. Однако, значительная щелевая коррозия может возникать в морской атмосфере или на наружной поверхности кузовов транспортных средств. В ходе транспортирования и хранения алюминиевых профилей иногда может собираться вода в щелях между смежными алюминиевыми поверхностями, которая вызывает поверхностную коррозию в виде «водяных пятен» (рисунок 4).
 Рисунок 5 – Сущность щелевой коррозии
Рисунок 5 – Сущность щелевой коррозии
Источником этой воды является дождь или конденсация влаги. Эта вода по капиллярному механизму буквально засасывается в пространство между двумя металлическими поверхностями. Конденсация влаги может возникать тогда, когда холодный материал помещают в теплое помещение. Разность между ночной и дневной температурами может также вызывать конденсацию, когда алюминий хранится снаружи под плотным тентом, который препятствует вентиляции.
Предотвращение щелевой коррозии
На соединяемые поверхности наносят герметики или двухсторонний скотч. Это предотвращает попадание в зазор между ними воды и предотвращает возникновение щелевой коррозии.
В некоторых случаях вместо соединения на заклепках и винтах применяют клеевое соединение. Это также противодействует образованию щелевой коррозии.
 Рисунок 6 – Герметизация соединения предотвращает щелевую коррозию
Рисунок 6 – Герметизация соединения предотвращает щелевую коррозию
Широкое распространение алюминия в строительстве в первую очередь объясняется его высокими технологическими качествами и высокой стойкостью в воздушной среде. Стандартный потенциал алюминия очень низкий, и в термодинамическом отношении он очень не устойчив, однако благодаря легкому образованию защитной пленки А1203 и легкому ее восстановлению после механического повреждения коррозия может возникнуть в жидкости только при наличии сверхтонкой защитной пленки. Наличие на поверхности алюминия участков сверхтонкой пленки, способной проводить только электроны, обеспечивает возникновение катодных процессов, вызывающих в нейтральных водных растворах коррозионные пятна или точки.
Алюминий не устойчив как в кислых, так и в щелочных средах. Контакт алюминия со щелочью вызывает реакцию образования водорастворимого алюмината. Алюминий корродирует в жидкой среде с водородными показателями рН<3 или рН>11, в воздушной среде, содержащей примеси хлора, хлористого водорода, фтористого водорода, а также при контакте с веществами, в состав которых входят ртуть, медь, олово, никель, свинец, при контакте с углем и коксом.
Коррозия алюминия в агрессивных жидкостях может быть существенно снижена или даже прекращена добавкой в агрессивную среду ингибиторов коррозии. Можно добиться практически полного прекращения коррозии алюминия в щелочных средах путем введения в среду хромата натрия концентрацией 1-5%, силикатов натрия или калия с кремнефтористым натрием, органических веществ, таких как агар-агар, декстрин, желатин.
Алюминий и его сплавы в промышленной атмосфере, а также в пресной воде при отсутствии абразивных и кавитационных явлений от коррозии могут быть защищены путем электрохимического анодирования с толщиной покрытия 15-20 мкм или химическим оксидированием толщиной 5 мкм с последующим нанесением лакокрасочного покрытия II или III группы. В условиях повышенной влажности при наличии в атмосфере газов, образующих с влагой кислоты, строительные конструкции, изготовленные из алюминиево-магниевых сплавов (АМц-М, МАц-I I, АМг I I, АМг-М, АМг61-М), от коррозии не защищаются.
В морской воде анодирование менее эффективно, поэтому для предотвращения местной коррозии в местах дефектов анодированного покрытия необходимо наносить лакокрасочное покрытие IV группы с одновременным устройством катодной защиты.
Повышение стойкости алюминиевых сплавов достигается плакированием сплава чистым алюминием, хромированием, никелированием. В промышленных и морских районах для защиты конструкций применяются цинковые покрытия. Для защиты от конктной коррозии алюминия и сплавов применяется покрытие кадмием. Алюминий от почвенной коррозии защищают битумным покрытием толщиной не менее 5 мм, наносимым на поверхность металла в горячем виде.
Для защиты алюминия от контактной коррозии, возникающей при наличии в конструкции, кроме алюминия, других металлов, включая и алюминиевые сплавы АМц и АМг-2, необходимо предусматривать электроизоляцию. Для этого в местах контакта разнородных металлов наносят прочное лакокрасочное покрытие, которое не разрушается при сборке конструкции. При наличии контакта алюминия с медью необходимо устройство изоляции в виде прокладки. Аналогичная изоляция должна также обеспечиваться в сильноагрессивной среде при контакте алюминия и его сплавов с нержавеющей сталью и титаном. Защита от контактной коррозии должна также обеспечиваться в случае применения алюминия в качестве металлизационного защитного покрытия других металлов.