ОПРЕДЕЛЕНИЕ
Алюминий расположен в третьем периоде, III группе главной (A) подгруппе Периодической таблицы. Это первый p-элемент 3-го периода.
Металл. Обозначение - Al. Порядковый номер - 13. Относительная атомная масса - 26,981 а.е.м.
Электронное строение атома алюминия
Атом алюминия состоит из положительно заряженного ядра (+13), внутри которого находится 13 протонов и 14 нейтронов. Ядро окружено тремя оболочками, по которым движутся 13 электронов.
Рис. 1. Схематическое изображение строения атома алюминия.
Распределение электронов по орбиталям выглядит следующим образом:
13Al) 2) 8) 3 ;
1s 2 2s 2 2p 6 3s 2 3p 1 .
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:
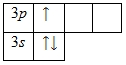
Теоретически возможно возбужденное состояние для атома алюминия за счет наличия вакантной 3d -орбитали. Однако распаривания электронов 3s -подуровня на деле не происходит.
Примеры решения задач
ПРИМЕР 1
3 главная Дайте характеристику элементу, вставив пропущенные слова 1.Алюминий - элемент III группы, главной подгруппы. 2.Заряд ядра атома алюминия равен В ядре атома алюминия 13 протонов. 4.В ядре атома алюминия 14 нейтронов. 5.В атоме алюминия 13 электронов. 6.Атом алюминия имеет 3 энергетических уровня. 7.Электронная оболочка имеет строение 2е, 8е, 3е. 8.На внешнем уровне в атоме 3 электронов. 9.Степень окисления атома в соединениях равна Простое вещество алюминий является металлом. 11.Оксид и гидроксид алюминия имеют амфотерный характер. Далее

4 Электронное строение атома 27 АlАl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 Краткая электронная запись 1s21s2 2s22s2 2p 6 3s 2 3p 1 Порядок заполнения главная Далее



7 Из истории открытия Главная Далее В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции. Далее





12 1.Серебристо-белый металл 2.Металлический блеск 3.Самый твёрдый металл 4.Tемпература плавления +660 о С 5.Пластичный 6.Легко режется ножом 7.Проводит электрический ток 8.Лёгкий 9.Проводит тепло 10.Легко намагничивается и размагничивается 11.Мягкий Выберите и запишите цифры тех свойств, которые относятся к физическим свойствам алюминия







Физические свойства Алюминий - серебристо белый металл. Плавиться при 660 о С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами легкие и прочные сплавы



Из истории открытия В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.


Проверь себя 1.Сколько электронов в атоме алюминия? а) 1 б) 6 в) 13 г) 3 2. Степень окисления атома алюминия в соединении Al 2 О 3 а) -3 б) -2 в) +3 г)+2 3. К амфотерным гидроксидам относится: а) Mg(OH) 2 б) Al(OH) 3 в) H 2 Cr 2 O 7 г) Na OH 4. При окислении алюминия в щелочной среде образуется… а)Al 3+ б) Al 2 O 3 в) - г) Al H 3 5. Оксид алюминия - … а) твердое вещество белого цвета б) газ без цвета и запаха в) твердое вещество красного цвета г) легкокипящая жидкость
 Вывод Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое применение в авиационном и космическом транспорте и во многих отраслях народного хозяйства. Особое место алюминий и его сплавы занимают в электротехнике, а за ними будущее нашей науки и техники.
Вывод Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое применение в авиационном и космическом транспорте и во многих отраслях народного хозяйства. Особое место алюминий и его сплавы занимают в электротехнике, а за ними будущее нашей науки и техники.

МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ОБЩАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81
Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
учитель химии
МБОУ ООШ №81
2013г
Тема урока: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
Цели урока:
рассмотреть распространение алюминия в природе, его физические и химические свойства, а также свойства образуемых им соединений.
Ход работы
1. Организационный момент урока. 2. Изучение нового материала. Алюминий Главную подгруппу III группы периодической системы составляют бор (В), (А l), галлий (Ga), индий (In) и таллий (Т l). Как видно из приведенных данных, все эти элементы были открыты в XIXстолетии.Открытие металлов главной подгруппы
III
группы

В
Бор представляет собой неметалл. Алюминий - переходный металл, а галлий, индий и таллий - полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются. В данной лекции мы подробнее рассмотрим свойства алюминия. 1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления. Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.Al +13) 2 ) 8 ) 3 , p – элемент,
Основное состояние
1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
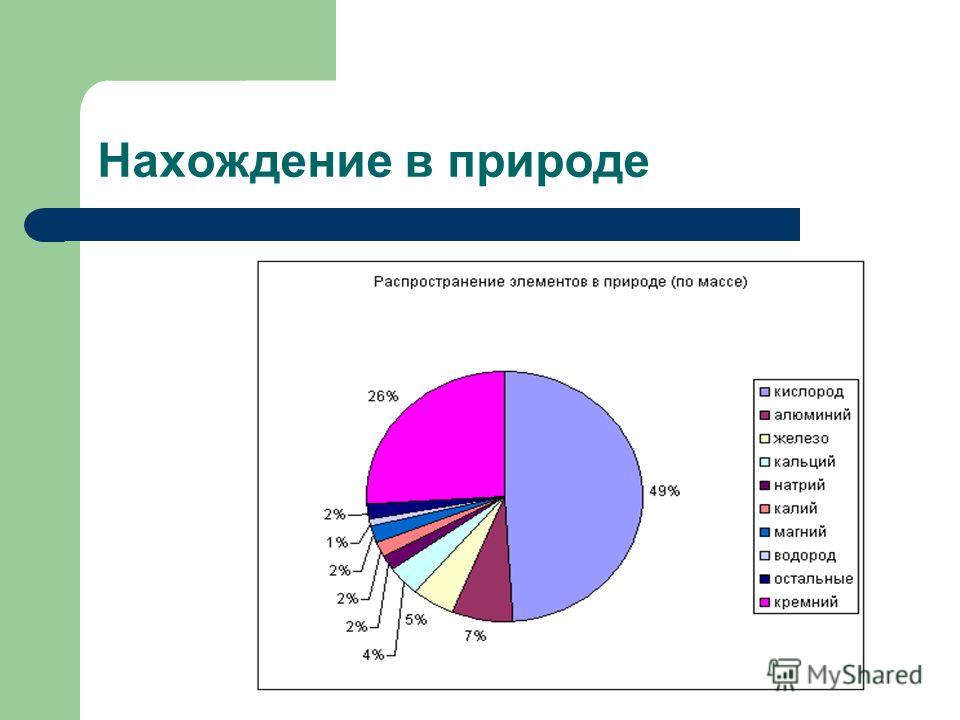
Алюминий проявляет в соединениях степень окисления +3: Al 0 – 3 e - → Al +3 2. Физические свойства Алюминий в свободном виде - серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 о С. Алюминий имеет невысокую плотность (2,7 г/см 3 ) - примерно втрое меньше, чем у железа или меди, и одновременно - это прочный металл. 3. Нахождение в природе По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов , уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры. В природе алюминий встречается только в соединениях (минералах). Некоторые из них: Бокситы - Al 2 O 3 H 2 O (с примесями SiO 2 , Fe 2 O 3 , CaCO 3 ) Нефелины - KNa 3 4 Алуниты - KAl(SO 4 ) 2 2Al(OH) 3 Глинозёмы (смеси каолинов с песком SiO 2 , известняком CaCO 3 , магнезитом MgCO 3 ) Корунд - Al 2 O 3 Полевой шпат (ортоклаз) - K 2 O×Al 2 O 3 ×6SiO 2 Каолинит - Al 2 O 3 ×2SiO 2 × 2H 2 O Алунит - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3 Берилл - 3ВеО Al 2 О 3 6SiO 2Боксит
4. Химические свойства алюминия и его соединений Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия с ртутью – амальгамы).I . Взаимодействие с простыми веществами Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора - воды: 2А l + 3 S = А l 2 S 3 (сульфид алюминия), 2А l + N 2 = 2А lN (нитрид алюминия), А l + Р = А lР (фосфид алюминия), 4А l + 3С = А l 4 С 3 (карбид алюминия). 2 Аl + 3 I 2 = 2 A lI 3 (йодид алюминия) Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана: Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S Al 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4 В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты: 4А l + 3 O 2 = 2А l 2 О 3 + 1676 кДж.
II . Взаимодействие со сложными веществами Взаимодействие с водой : 2 Al + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 без оксидной пленки Взаимодействие с оксидами металлов: Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов . Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др. 3 Fe 3 O 4 + 8 Al = 4 Al 2 O 3 + 9 Fe + QТермитная смесь Fe 3 O 4 и Al (порошок) –используется ещё и в термитной сварке. С r 2 О 3 + 2А l = 2С r + А l 2 О 3 Взаимодействие с кислотами : С раствором серной кислоты: 2 Al + 3 H 2 SO 4 = Al 2 (SO 4 ) 3 + 3 H 2 С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода: 2А l + 6Н 2 SО 4(конц) = А l 2 (SО 4 ) 3 + 3 SО 2 + 6Н 2 О, А l + 6Н NO 3(конц) = А l(NO 3 ) 3 + 3 NO 2 + 3Н 2 О. Взаимодействие со щелочами . 2 Al + 2 NaOH + 6 H 2 O = 2 Na Al(OH) 4 + 3 H 2 Na [А l (ОН) 4 ] – тетрагидроксоалюминат натрия По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов. С растворами солей: 2 Al + 3 CuSO 4 = Al 2 (SO 4 ) 3 + 3 CuЕсли поверхность алюминия потереть солью ртути, то происходит реакция: 2 Al + 3 HgCl 2 = 2 AlCl 3 + 3 Hg Выделившаяся ртуть растворяет алюминий, образуя амальгаму. 5. Применение алюминия и его соединений

Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность : самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода : при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди. Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты . Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных. Оксид алюминия используется для получения алюминия, а также как огнеупорный материал. Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок. Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии. Таким образом, сульфат алюминия является коагулянтом. 6. Получение алюминия 1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na 3 AlF 6 растворяет Al 2 O 3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия - электролитом. 2Al 2 O 3 эл.ток → 4Al + 3O 2 В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век - век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес. 2) 2Al 2 O 3 + 3 C = 4 Al + 3 CO 2 ЭТО ИНТЕРЕСНО:
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета "Сатурн" сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе? №2. Закончите уравнения химических реакций:
Al + H 2 SO 4 (раствор) ->
Al + CuCl 2 ->
Al + HNO 3 (конц) - t ->
Al + NaOH + H 2 O -> №3. Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г? 4. Домашнее задание Примечание: на уроке может использоваться презентация « Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.»
Цели урока:
Обучающая – изучить физические и химические свойства алюминия и области его применения. Рассмотреть характеристику химического элемента алюминия и изучить строение атома.
Развивающая – развивать умения в проведении эксперимента, перенесении содержания научно-познавательного текста в форму схем; развитие коммуникативных способностей, умения слушать, умение правильно высказывать свои мысли.
Воспитательная – воспитывать культуру работы с химическими веществами, соблюдение правил техники безопасности, воспитывать сознательную дисциплинированность, четкость и организованность в работе.
Учащиеся должны знать:
строение атома алюминия, физические и химические свойства алюминия как простого вещества, области применения.
Учащиеся должны уметь:
давать характеристику алюминия, как химического элемента, так и простого вещества. Записывать уравнения реакций, доказывающие химические свойства алюминия в молекулярном и окислительно-восстановительном виде.
Тип урока:
изучение нового материала.
Форма организации учебной деятельности учащихся:
групповая работа, индивидуальная, химический эксперимент.
Методы и приемы обучения:
поисковый, частично-исследовательский, демонстрационный химический эксперимент, работа в группах, устные ответы у доски, самостоятельная работа с текстами, взаимоконтроль.
Оборудование урока:
научно-познавательные тексты по теме урока, карточки-задания по отдельному вопросы плана изучения материала для каждой группы, ПСХЭ,
Коллекция «Алюминий и его соединения», алюминиевая фольга, соляная кислота и гидроксид натрия, алюминий, лабораторное оборудование.
1. Организационный момент.
Учитель приветствует учащихся.
2. Актуализация опорных знаний, сообщение темы, задач и структуры проведения урока:
Вступительное слово учителя
Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Мы продолжаем изучение большой и важной темы «Металлы». Сегодня на уроке нам предстоит познакомиться с металлом хорошо известным вами с детства. Данный урок я хочу начать с легенды.
«Однажды к римскому императору Тиберию пришел незнакомец. В дар императору он принес изготовленную им чашу из блестящего, как серебро, но чрезвычайно легкого металла. Мастер поведал, что получил этот металл из «Глинистой земли». Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить». О каком металле идет речь?
(Об алюминии)
Учитель:
Таким образом, тема нашего урока: «Алюминий – химический элемент и простое вещество».
Формулируются задачи урока.
План изучения темы в группах:
- Физические свойства алюминия.
- Химические свойства алюминия.
- Применение алюминия и нахождение его в природе.
План работы в группе:
Изучите текст и выделите сведения, относящиеся к своему вопросу;
- выполните предложенные задания;
- подготовьте выступление по своему вопросу, основываясь на краткости, ясности и четкости изложения
Групповая работа по изучению материала.
Подготовка выступления по своему вопросу.
Группа 1.
Характеристика химического элемента алюминия по положению его в ПСХЭ.
Задание:
- Ознакомьтесь с текстом.
- Дайте характеристику алюминию по положению в ПСХЭ по плану:
А) порядковый номер.
Б) атомная масса.
В) период (малый, большой).
Г) группа (подгруппа: главная или побочная).
Д) химический знак.
Е) Строение атома (заряд ядра, число протонов, электронов, нейтронов, электронная формула).
И) оксиды.
К) летучие водородные соединения.
2. Обсудите в группе полученные результаты и ответьте на вопросы:
- Сколько электронов находится на внешнем уровне атома алюминия?
- Алюминий будет отдавать или принимать данные электроны?
- Какую степень окисления будет приобретать при этом ион алюминия?
- Сделайте вывод: К какому классу соединений относится алюминий (металл или неметалл)
- Сравните активность химического элемента алюминия с элементами 1 и 2 групп этого же периода.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 2.
Физические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Рассмотрите коллекцию «Алюминий и его сплавы».
- Обсудите в группе вопросы:
- а) Агрегатное состояние, цвет, блеск, плотность (легкий или тяжелый), плавкость (легко –или тугоплавкий), электро- и теплопроводность, пластичный.
- б) Полученные данные изобразите в виде схемы.
5. Подготовьте выступление поданному вопросу, основываясь на краткости четкости изложении.
Группа 3.
Химические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Изучите, как ведет себя алюминий по отношению к сложным веществам?
- Выполните лабораторную работу, используя инструкцию
Задание:
А) Выполните опыты.
Б) Обговорите в группе наблюдаемые явления.
В) Запишите уравнение реакций.
Г) Сделайте выводы.
5. Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 4.
Применение алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Обсудите в группе следующие вопросы:
а) Какова роль алюминия в жизни человека?
б) Применение алюминия, как простого вещества.
- Составьте схему, характеризующую области применения алюминия.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении
- Отчет групп по изученным вопросам.
Каждая группа, выполнив все задания, представляет схематизированное изложение своего вопроса с обсуждением и комментариями, учащиеся делают записи, переносят предложенные схемы в тетради, в результате всех групп поэтапно составляется опорный конспект по теме урока.
Выводы по теме урока:
Какое количество электронов находится на внешнем энергетическом уровне атома алюминия.
- Какую степень окисления имеет атом алюминия? Почему? А ион?
- При помощи каких опытов мы доказали, что алюминий – это активный металл?
- Какие вещества называются амфотерными?
- На каких свойствах основаны следующие области применения?
- Где в организме больше всего содержится алюминия?
- Можно ли длительное время хранить продукты питания в алюминиевой посуде?
- Домашнее задание: § 13 до стр. 60, ? 1, 4. Подготовить презентацию по применению алюминия.
- Заключительное слово учителя.
Учитель благодарит учащихся за сотрудничество, выставляет оценки выступающим у доски.
Справка.
Алюминий.
В главную подгруппу III группы входят элементы: бор, алюминий, галлий, индий, таллий. На внешнем электронном слое атомы этих элементов содержат три электрона (…ns2np1). Они являются р-элементами. В реакциях атомы этих элементов являются восстановителями, за исключением неметалла бора, он может быть окислителем. Все элементы этой подгруппы проявляют высшую степень окисления +3. Они образуют высшие оксиды Э2О3 и гидроксиды Э(ОН)3, которые проявляют амфотерные свойства. Наибольший интерес в этой подгруппе представляют алюминий.
Алюминий в свободном виде – серебристо-белый металл, обладает блеском, высокой тепло-электропроводностью (уступает в этом отношении меди), легкий (плотность 2,7 г/см3) и одновременно – это прочный металл. Является мягким, пластичным металлом, его можно прокатывать в фольгу, вытягивается в проволоку. Плавится при температуре 6600С. При 6000С алюминий становится хрупким и его можно истолочь в зерна или в порошок.
Алюминий – металл, поверхность которого обычно покрыта тонкой, прочной оксидной пленкой. Виде стружек и порошка он ярко горит на воздухе, выделяя большое количество теплоты.
При комнатной температуре активно реагирует с галогенами, при нагревании взаимодействует с серой (2000С), азотом (8000 С) и другими неметаллами.
Отношение алюминия к сложным веществам:
Алюминий растворяется в соляной кислоте любой концентрации:
Алюминий растворяется в растворах щелочей:
Алюминий играет важную биологическую роль в жизни человека. Он принимает участие в построении эпителиальной и соединительной тканях. Содержание алюминия в организме человека (на 70 кг массы тела) составляет 61 мг. Находится во всех органах и тканях: больше всего в печени, легких, костях головном мозге. Основным поступлением алюминия в организм является пища – это хлебопродукты, чай (от 20 – 200мг на 100г. продукта), картофель – 4 мг на 100г. продукта, желтая репа – 46 мг на 100 г. продукта.
При приготовлении и хранении пищи в алюминиевой посуде содержание алюминия в продуктах увеличивается вдвое. Повышение содержания алюминия в крови вызывает возбуждение центральной нервной системы. При избытке алюминия в организме нарушается двигательная активность, судороги, ослабление памяти, заболевание печени и почек. При понижении содержания алюминия происходит торможение центральной нервной системы.
Области применения алюминия весьма многочисленны. Благодаря легкости и прочности алюминий и его сплавы применяют в самолето- и ракетостроении (алюминий называют крылатым металлом), строительстве судов и автомобилей; в строительстве- для изготовления оконных рам и дверей, легкость и хорошая электрическая проводимость алюминия используется при изготовлении электрических проводов для линии электропередач. Теплопроводность и неядовитость важны при изготовлении алюминиевой посуды и фольги для хранения пищевых продуктов. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии. Способность алюминия гореть в воздухе ярким пламенем, используется при приготовлении красочных фейерверков и изготовление бенгальских огней.














