Тема: Химические свойства элементов.
План:
1.Свойства металлов и их соединений (I и II гл. подгр.)
1.1 Элементы IA
1.2 Элементы IIA группы общая характеристика.
2. Химические свойства р элементов.
2.1 Элементы IIIA группы общая характеристика.
2.2 Элементы IVA группы общая характеристика.
2.3 Элементы VA группы общая характеристика.
2.4 Элементы VIA группы общая характеристика.
2.5 Элементы VIIA группы общая характеристика.
2.6 Элементы VIIIA группы общая характеристика.
3.Водород
Щелочные металлы элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.Г. Дэви в 1807 г. впервые получил свободные калий и натрий.
Во внешнем электрнном слое атомы щелочных металлов имеют по одному электрону. Во втором снаружи электронном слое у атома лития содержатся два электрона, а у атомов остальных щелочных металлов по восемь электронов. Имея во внешнем электронном слое только по одному электрону, находящемуся на сравнительно большом удалении от ядра, атомы этих элементов довольно легко отдают этот электрон, т. е. характеризуются низкой энергией ионизации. Образующиеся при этом однозарядные положительные ионы имеют устойчивую электронную структуру соответствующего благородного газа (ион лития структуру атома гелия, ион натрия атома неона и т. д.). Легкость отдачи внешних электронов характеризует рассматриваемые элементы как наиболее типичные представители металлов: металлические свойства выражены у щелочных металлов особенно резко.
Одинаковое строение не только наружного, но и предпоследнего электронного слоя атомов всех щелочных металлов, кроме лития, обусловливает большое сходство свойств этих элементов. В то же время увеличение заряда ядра и общего числа электронов в атоме при переходе сверху вниз по подгруппе создает некоторые различия в их свойствах. Как и в других группах, эти различия проявляются главным образом в увеличении легкости отдачи валентных электронов и усилении металлических свойств с возрастанием порядкового номера.
|
Свойства щелочных металлов |
||||||||
|
Атомный |
Название, |
Металлический |
Ионный |
Потенциал |
ЭО |
p, |
t
пл
, |
t
кип
, |
|
Литий Li |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
Натрий Na |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
Калий K |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
Рубидий Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
Цезий Cs |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
Химические свойства щелочных металлов. Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов
их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет. 2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: ![]()
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода: 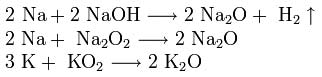
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
|
Формула |
Цвет |
|
Li 2 O |
Белый |
|
Na 2 O |
Белый |
|
K 2 O |
Желтоватый |
|
Rb 2 O |
Жёлтый |
|
Cs 2 O |
Оранжевый |
|
Na 2 O 2 |
Светло- |
|
KO 2 |
Оранжевый |
|
RbO 2 |
Тёмно- |
|
CsO 2 |
Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
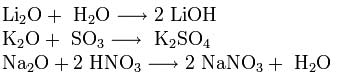
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием
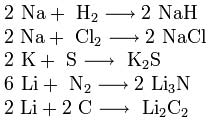 гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
|
Окраска пламени щелочными металлами |
|
|
Карминно-красный |
|
|
Жёлтый |
|
|
Фиолетовый |
|
|
Беловато-розовый |
|
|
Фиолетово-красный |
|
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего хлоридов, образующих природные минералы:
катод: Li+ + e → Liанод: 2Cl- 2e → Cl22. Иногда для получения щелочных металлов проводят
электролиз расплавов их гидроксидов:
катод: Na+ + e → Naанод: 4OH- 4e → 2H2O + O2Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
В природе щелочные металлы встречаются исключительно в виде соединений. Натрий и калий являются постоянными составными частями многих весьма распространенных силикатов . Из отдельных минералов натрия важнейшийповаренная соль (NaCl) входит в состав морской воды и на отдельных участках земной поверхности образует под слоем наносных пород громадные залежи так называемой каменной соли (в СССР Соликамск, Артемовен, Илецк и т. д.). В верхних слоях подобных залежей иногда содержатся и скопления солей калия [в виде минералов сильвинита (KClNaCl), карналлита (KCl·MgCl2 ·6Н2 О) и др.], служащие основным источником получения соединений этого элемента. Имеющих промышленное значение природных скоплений калийных солей известно лишь немного. Важнейшим из них является Соликамское месторождение в СССР.
Для лития известен ряд минералов [например, сподумен LiAl (SiO3 ) 2 ], но скопления их редки. Рубидий и цезий встречаются почти исключительно в виде примесей к другим щелочным металлам . Следы франция всегда содержатся з урановых рудах .
Соединения натрия и калия имеют огромное значение для жизни. Достаточно напомнить хотя бы то, что человек потребляет ежегодно 510 кг NaCl Подобным же образом для растений необходимы соли калия . В связи с этим около 90% всех добываемых калийных соединений употребляются для удобрения почв. Остальные 10%, равно как и громадные количества различных соединений натрия , используются в промышленности. Лишь сравнительно небольшое по объему применение находят пока производные лития и весьма ограниченное соединения Rb и Cs.
В свободном состоянии щелочные металлы могут быть выделены электролизом их расплавленных хлористых солей . Основное практическое значение имеет натрий , ежегодная мировая выработка которого составляет более 50 тыс. т.
В главную подгруппу II группы входят элементы б epu ллий, магний, кальций, стронций, барий и радий . Все эти элементы, кроме бериллия, обладают ярко выраженными металлическими свойствами. В свободном состоян ии они представляют собой серебристо-белые вещества, более твердые, чем щелочные металлы, с довольно высокими температурами плавления. По плотности все они, кроме радия, относятся к легким металлам.
Первые два члена рассматриваемой подгруппы занимают в ней несколько особое положение, отличаясь во многих отношениях от остальных четырех элементов. Б ериллий по некоторым своим свойствам приближается к алюминию .
Все изотопы последнего элемента подгруппы радия радиоактивны. Долгоживущий изотоп 226 Ra раньше использовался в радиотерапии; в настоящее время его заменили более дешевыми изотопами других элементов, образующимися в ядерных реакторах.
В наружном электронном слое атомы элементов этой подгруппы имеют два электрона, во втором снаружи слое у бериллия находится два электрона, а у остальных элементов восемь.
Простые вещества, образуемые атомами этих элементов, металлы. Литий, натрий, калий, рубидий, цезий и франций называют щелочными металлами, так как их гидроксиды представляют собой щелочи. Кальций, стронций и барий называют щелочноземельными металлами. Химическая активность этих веществ увеличивается по мере увеличения атомного радиуса. Из химических свойств этих металлов наиболее важны их восстановительные свойства. Щелочные металлы сильнейшие восстановители. Металлы элементов IIA группы также довольно сильные восстановители. Все они (кроме бериллия) реагируют с водой (магний при кипячении):
2M + 2H 2 O = 2M aq + 2OH aq + H 2 ,M + 2H 2 O = M 2 + 2OH + H 2 .
В случае магния, кальция и стронция из-за малой растворимости образующихся гидроксидов реакция сопровождается образованием осадка:
M 2 + 2OH = Mg(OH) 2
Щелочные металлы реагируют с большинством неметаллов: 2M + H 2 = 2MH (при нагревании), 4M + O 2 = 2M 2 O (M Li), 2M + Cl 2 = 2MCl (при обычных условиях), 2M + S = M 2 S (при нагревании).
Из щелочных металлов, сгорая в кислороде, обычный оксид образует только литий. Остальные щелочные металлы образуют пероксиды (M
2
O
2
) или надпероксиды (MO
2
соединения, содержащие надпероксид-ион с формальным зарядом 1 е).Как и щелочные металлы, металлы элементов IIA группы реагируют со многими неметаллами, но при более жестких условиях: M + H
2
= MH
2
(при нагревании; кроме бериллия),
2M + O
2
= 2MO (при обычных условиях; Be и Mg при нагревании),M + Cl
2
= MCl
2
(при обычных условиях),M + S = MS (при нагревании). В отличие от щелочных металлов с кислородом они образуют обычные оксиды. С кислотами спокойно реагирует только магний и бериллий, остальные простые вещества очень бурно, часто со взрывом.Бериллий реагирует с концентрированными растворами щелочей:Be + 2OH
+ 2H
2
O =
2
+ H
2
В соответствии с положением в ряду напряжений с растворами солей реагируют только бериллий и магний, остальные металлы в этом случае реагируют с водой. Являясь сильными восстановителями, щелочные и щелочноземельные металлы восстанавливают многие менее активные металлы из их соединений, например, при нагревании протекают реакции:4Na + MnO
2
= 2Na
2
O + Mn;2Ca + SnO
2
= 2CaO + Sn.Общий для всех щелочных металлов и металлов IIA группы промышленный способ получения электролиз расплавов солей.
Кроме бериллия оксиды всех рассматриваемых элементов основные оксиды, а гидроксиды сильные основания (у бериллия эти соединения амфотерные, гидроксид магния слабое основание). Усиление основных свойств гидроксидов с увеличением порядкового номера элемента в группе легко прослеживается в ряду гидроксидов элементов IIA группы. Be(OH)
2
амфотерный гидроксид, Mg(OH)
2
слабое основание, Ca(OH)
2
, Sr(OH)
2
и Ba(OH)
2
сильные основания, но с увеличением порядкового номера растет их растворимость, и Ba(OH)
2
уже можно отнести к щелочам.
Все щелочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щелочноземельным металлом является кальций , количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний , количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций , которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6×10−4 % от массы земной коры. Что касается радия , который радиоактивен, то это самый редкий из всех щелочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1×10−10 % (от массы земной коры)/
К р-элементам III группы периодической системы Д. И. Менделеева относятся: бор В, алюминий Аl, галлий Ga, индий In и таллий Тl. Электронная конфигурация атомов ns2 np1 .
Ниже сопоставлены некоторые константы, характеризующие свойства атомов p-элементов рассматриваемой группы и соответствующих металлических веществ:
На свойствах р-элементов III группы сказывается d-сжатие (Аl располагается в периодической системе в малом III периоде, a Ga, In и Тl в больших периодах непосредственно после d-элементов). Так, от Аl к Ga атомный радиус несколько уменьшается, а первый ионизационный потенциал возрастает. На свойствах атомов таллия, кроме того, сказывается и f-сжатие. Именно поэтому радиус атома Тl близок радиусу атома In, а энергия ионизации несколько выше.
Бор. В соответствии с электронной структурой атома (1s2 2s2 2p1 ) бор может быть одновалентным (один неспаренный электрон на энергетическом 2р-подуровне). Однако для бора наиболее характерны соединения, в которых он трехвалентен (при возбуждении атома три неспаренных электрона в энергетических 2s- и 2р-подуровнях).
Свободная 2р-орбиталь в возбужденном атоме бора обусловливает акцепторные свойства многих его соединений, в которых три ковалентные связи образованы по обменному кова-лентному механизму (например, ВВг3 ). Эти соединения склонны к присоединению частиц с электронно-донорными свойствами, т. е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму. Например:
BBr3 + Br- = [ВВr4 ]-
Известны два изотопа бора: 105 В (19,6%) и 11 5 B (80,4%). Ядра атомов изотопа (105 В) легко поглощают нейтроны:
105 В + 1 0 n = 4 2 He + 7 5 Li
Способность бора поглощать нейтроны обусловливает его применение в ядерной энергетике: из борсодержащих материалов делают регулирующие стержни ядерных реакторов.
Кристаллы бора черного цвета; они тугоплавки (т. пл. 2300 °С), диамагнитны, обладают полупроводниковыми свойствами (ширина запрещенной зоны ΔE=1,55 эВ). Электрическая проводимость бора, как и других металлов, мала и несколько возрастает при повышении температуры.
При комнатной температуре бор химически инертен и взаимодействует непосредственно только с фтором; при нагревании бор окисляется хлором, кислородом и некоторыми другими неметаллами. Например:
4В + 3O2 = 2В2 O3
2В + ЗСl2 = 2ВСl3
В соединениях с неметаллами степень окисления бора +3; все эти соединения ковалентны.
Триоксид бора В2 O3 кристаллическое вещество (т. пл. 450 °С, т. кип. 2250 °С), характеризующееся высокими значениями энтальпии и энергии Гиббса образования. При взаимодействии с водой В2 O3 переходит в борную кислоту:
В2 O3 + ЗН2 O = 2Н3 ВO3
Н3 ВО3 очень слабая (Kд ≈ 10-9 ) одноосновная кислота. Электролитическая диссоциация Н3 ВО3 с отщеплением только одного иона Н+ объясняется уже описанными ранее акцепторными свойствами бора: свободная 2р-орбиталь атома бора предоставляется электронному донору ОН- , образующемуся при диссоциации молекул Н2 O. Процесс протекает по схеме
Н3 ВО3 + Н2 O = Н[В(ОН)4 ] = Н+ + [В(ОН)4]-
Комплексный анион [В(ОН)4 ]- имеет тетраэдрическую структуру (sp3 -гибридизация электронных орбиталей). Акцепторные свойства бора в соединениях со степенью окисления + 3 проявляются и в химии его галогенидов. Так, например, легко осуществимы реакции
BF3 + F- = -
BF3 + NH3 =
в которых химическая связь между BF и F- или NH3 образуется по донорно-акцепторному механизму. Свойство галогенидов бора быть акцепторами электронов обусловливает их широкое применение как катализаторов в реакциях синтеза органических соединений.
Непосредственно с водородом бор не взаимодействует, а с металлами образует бор иды обычно нестехиометрические соединения Ме4 В, Ме2 В, МеВ, Ме3 В4 , МеВ2 и МеВ6 .
Гидриды бора (бораны) очень ядовиты и имеют весьма неприятный запах. Их получают косвенным путем, чаще всего
при взаимодействии химически активных боридов с кислотами или галогенидов бора с гидридами щелочных металлов:
6MgB2 + 12НСl = Н2 + 8В + В4 Н10 + 6MgCl2
8BF3 + 6LiH = В2 Н6 + 6LiBF4
Простейшее соединение бора с водородом ВН3 в обычных условиях не существует, sp2 -Гибридизация электронных орбиталей в атоме бора приводит к координационной ненасыщенности частицы ВНз, вследствие чего происходит объединение двух таких частиц в молекулу диборана: 2ВНз = В2 Н6 (ΔG0 298 = -127 кДж/моль).
В диборане В2 Н6 бор находится в состоянии 5р3 -гибридизации, причем у каждого атома бора одна из четырех гибридных орбиталей пуста, а три другие перекрыты s-орбиталями атомов водорода. Связи между группами ВНз в молекуле В2 Н6 образуются по типу водородной связи за счет смещения электронной плотности от одного атома водорода группы ВНз к пустой орбитали другой группы ВНз. Известны и другие бораны, которые можно представить двумя рядами Bn Hn+4 и Bn Hn+6 .
Бориды s-металлов химически активны и часто используются для получения смеси боранов при обработке кислотами. Большинство боридов d- и f-металлов жаростойки, очень тверды, химически устойчивы. Их широко используют непосредственно в виде сплавов для изготовления деталей реактивных двигателей, лопаток газовых турбин. Некоторые бориды применяют для изготовления катодов электронных приборов.
Алюминий. Электронная конфигурация атома алюминия выражается формулой 1s2 2s2 2p6 3s2 3p1 . На внешнем электронном слое атома есть один неспаренный электрон:
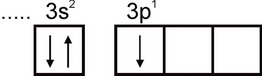
Поэтому алюминий может проявлять валентность, равную единице. Однако эта валентность для алюминия не характерна. Во всех устойчивых соединениях степень окисления алюминия равна +3. Валентность, равная трем, отвечает возбужденному состоянию атома Аl:
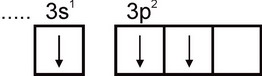
По своей распространенности алюминий занимает четвертое место среди всех элементов (после О, Н и Si) и является самым распространенным в природе металлом. Основная масса алюминия сосредоточена в алюмосиликатах: полевых шпатах, слюдах и др.
Алюминий серебристо-белый легкий и чрезвычайно пластичный металл, обладающий высокой теплопроводностью и электрической проводимостью.
Алюминий химически активен; с хлором и бромом он реагирует при комнатной температуре, а с иодом при нагревании или в присутствии воды как катализатора. При 800 °С алюминий взаимодействует с азотом, а при 2000 °С с углеродом. Алюминий проявляет высокое химическое сродство к кислороду (ΔG0 298 = -1582 кДж/моль):
2Аl + 0,502 = Аl2 O3 , ΔH0 298 = -1650 кДж/моль
На воздухе алюминий покрывается очень прочной тончайшей (10-8 м) оксидной пленкой, которая несколько ослабляет металлический блеск алюминия. Благодаря оксидной пленке поверхность алюминия приобретает высокую коррозионную стойкость. Это прежде всего проявляется в индифферентности алюминия к воде и водяному пару. Вследствие образования защитной пленки алюминий устойчив по отношению к концентрированным азотной и серной кислотам. Эти кислоты на холоду пассивируют алюминий. Склонность к пассивированию позволяет повышать коррозионную стойкость алюминия путем обработки его поверхности сильными окислителями (например, К2 Сr2 О7 ) или с помощью анодного окисления. При этом толщина оксидной пленки возрастает до 3·10-5 м. При высоких температурах прочность защитной пленки резко снижается. Если механическим воздействием снять оксидную пленку, алюминий становится крайне реакционноспособным. Он энергично взаимодействует с водой и водными растворами кислот и щелочей, вытесняя водород и образуя катионы или анионы. Взаимодействие алюминия с растворами кислот протекает по уравнению реакции
Аl + 6Н2 O + ЗН+ = [Аl(Н2 O)6 ]3+ + 0,5Н2
а с растворами щелочей
Аl + ЗН2 O + ОН- = [Аl(ОН)4 ]- + 0,5Н2
Катионы и анионы алюминия легко переходят друг в друга при изменении рН раствора:
[Аl(Н2 O)6 ]3+ + 4OH- = [Аl(ОН)4 ]- + 6Н2 O
[Аl(ОН)4 ]- + 4Н+ + 2Н2 O = [Аl(Н2 O)6 ]3+
В растворе могут образовываться и смешанные соединения, например [Аl(Н2 O)5 (ОН)]2+ ,[Аl(Н2 O)4 (ОН)2 ]+ , [Аl(Н2 O)3 (ОН)3 ]. Последнее легко (особенно при нагревании) дегидратируется и переходит в гидроксид А1(ОН)з:
[Аl(Н2 O)3 (ОН)3 ] = Аl(ОН)3 + ЗН2 O
Широчайшее применение алюминия в технике основано на его ценных физических и химических свойствах и большой распространенности в земной коре. Вследствие высокой электрической проводимости (4·10-5 Ом-1 ·см-1 ) и малой плотности он используется для изготовления электрических проводов. Высокая пластичность алюминия позволяет изготовлять из него тончайшую фольгу, которую применяют в конденсаторах и заменяют алюминием свинец в оболочках кабелей. Из-за ненамагничиваемости сплавы алюминия применяются в радиотехнике.
Основная масса алюминия используется для получения легких сплавов дуралюмина (94% Аl, остальное Сu, Mg, Мn, Fe и Si), силумина (8590 % Аl, 1014 % Si, остальное Na) и др. Алюминий применяется, кроме того, как легирующая добавка к сплавам для придания им жаростойкости. Алюминий и его сплавы занимают одно из главных мест как конструкционные материалы в самолетостроении, ракетостроении, машиностроении и т. п. Коррозионная стойкость алюминия (особенно анодированного) значительно превосходит коррозионную стойкость стали. Поэтому его сплавы используются как конструкционные материалы и в судостроении. С d-элеметами алюминий образует химические соединения интерметаллиды (алюминиды): NiAl, Ni3 Аl, CoAl и др., которые используются в качестве жаропрочных материалов. Алюминий применяется в алюминотермии для получения ряда металлов и для сварки термитным методом. Алюминотермия основана на высоком сродстве алюминия к кислороду. Например, в реакции, протекающей по уравнению
8Аl + 3Fe3 O4 = 4Аl2 O3 + 9Fe
выделяется около 3500 кДж теплоты и развивается температура до 3000 °С.
Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой является α-Аl2 O3 . Эта модификация встречается в земной коре в виде минерала корунда, из которого готовят шлифовальные диски и наждачные порошки. Применение корунда в качестве абразивного материала основано на его высокой твердости, уступающей лишь твердости алмаза, карборунда SiC и боразона BN. Сплавлением Аl2 O3 с Сг2 O3 получают искусственные рубины. Из них изготовляют опорные камни в точных механизмах. В последнее время искусственные рубины применяют в квантовых генераторах (лазерах). Изделия из Аl2 O3 используют как огнеупоры и диэлектрики.
Гидроксид алюминия Аl(ОН)3 полимерное соединение. Он имеет слоистую кристаллическую решетку. Каждый слой состоит из октаэдров Аl(ОН)6 (рис. 1); между слоями действует водородная связь. Получаемый по обменной реакции гидроксид алюминия студенистый белый осадок, хорошо растворимый в кислотах и щелочах. При стоянии осадок «стареет» и теряет свою химическую активность. При прокаливании гидроксид теряет воду и переходит в оксид Аl2 O3 . Одна из форм дегидратированного гидроксида алюмогель используется в технике в качестве адсорбента.
Чрезвычайно большой интерес представляют соединения алюминия цеолиты, относящиеся к алюмосиликатам. Их состав может быть выражен общей формулой Мех Эу O2y ·nН2 О, где MeСа или Na (реже Ва, Sr, К); Э Si и Аl в переменном соотношении. В кристаллах цеолитов имеются каналы, в которые могут внедряться молекулы Н2 О. Содержание воды в цеолитах колеблется в широких пределах в зависимости от давления водяного пара. Цеолиты способны обменивать со- держащуюся в них воду на другие жидкости (спирт и т. п.). При осторожном нагревании вода из цеолитов постепенно удаляется. Но даже полное обезвоживание не приводит к разрушению кристаллов цеолитов. Катионы Са2+ или Na+ в цеолитах образуют диффузионный слой; они не закреплены в кристаллической решетке, а вместе с водой располагаются в пустотах кристалла. Это объясняет наличие у цеолитов важных для технических целей катионообменных свойств. Возможность замены одних катионов другими позволяет применять цеолиты в качестве ионообменников.
Ряд искусственных цеолитов используется в качестве так называемых молекулярных сит. Кристаллы последних характеризуются наличием узких каналов диаметром от 3·10-10 до 13·10-10 м. Молекулярные сита поглощают вещества, молекулы которых могут войти в эти отверстия.
Например, молекулярное сито с диаметром отверстия 3,5·10-10 м может поглощать молекулы Н2 , O2 , N2 , но не поглощает более крупные молекулы СН4 или Аr. С помощью молекулярных сит можно разделять углеводороды, производить осушку газов и т. п.
Галлий, индий и таллий в виде простых веществ легкоплавкие серебристо-белые металлы. Физические и химические свойства Ga, In и Тl заметно отличаются от свойств Аl, несмотря на сходство электронной структуры внешнего энергетического уровня атомов рассматриваемых элементов.
Здесь, видимо, сказывается разница в электронной структуре предвнешнего энергетического уровня атомов Аl: (n-1)s2 (n-1)p6 с одной стороны и атомов Ga, In и Тl с другой: (n-1)s2 (n-1)р6 (n-1)d10 .
Степень окисления галлия и индия в устойчивых соединениях равна +3. Для таллия более характерна степень окисления + 1. Cоединения таллия, в которых степень окисления металла равна +3, являются сильными окислителями.
Галлий имеет широкий температурный интервал существования жидкого состояния. Низкая температура плавления (около 30 °С), высокая температура кипения (2205 °С) позволяют применять жидкий галлий для изготовления манометров.
Индий равномерно отражает световые волны всех длин и поэтому используется в точном приборостроении для изготовления зеркал. Кроме того, In входит в состав некоторых легкоплавких сплавов.
Таллий также вводится в некоторые сплавы, главным образом это сплавы с оловом и свинцом (кислотоупорные, подшипниковые).
Оксиды Ga2 O3 , In2 O3 и Тl2 O3 в воде практически нерастворимы. Заметное усиление основных свойств в ряду Ga2 O3 In2 O3 Тl2 O3 проявляется в возрастающей растворимости оксидов в кислотах.
Гидроксиды Ga(OH)3 , In(OH)3 , Тl(ОН)3 в воде так же нерастворимы, как и оксиды. Белый осадок Ga(OH)3 растворим в равной мере и в кислотах, и в щелочах, а красно-коричневый Тl(ОН)3 только в кислотах.
Галлий и индий образуют с р-элементами V группы периодической системы бинарные соединения типа AIII BV (например, GaP, GaAs, InSb и др.). В преобладающем большинстве соединений типа AIII BV электронные орбитали sр3 -гибридизованны; кристаллические решетки этих соединений имеют структуру, характеризующуюся тетраэдрическим расположением химических связей. Многие из этих алмазоподобных соединений полупроводники. Их используют как материал для выпрямителей переменного тока, датчиков, термоэлектрических генераторов и др.
Углерод, кремний, германий, олово и свинец составляют главную подгруппу IV группы
. Внешние энергетические уровни р-элементов IV группы содержат по четыре электрона (конфигурация ns2np2), из которых два спаренных s-электрона и два неспаренных р-электрона.
В невозбужденном состоянии элементы этой подгруппы проявляют валентность, равную двум. При переходе в возбужденное состояние, сопровождающееся переходом одного из s-электронов внешнего уровня в свободную ячейку р-подуровня того же уровня, все электроны наружного слоя становятся неспаренными, и валентность при этом возрастает до 4.
Сера, селен, теллур и полоний тоже имеют на внешнем уровне 6 электронов (s 2 p 4 ), но у всех у них есть незаполненный d-уровень, поэтому они могут иметь до 6 неспаренных электронов и в соединениях проявлять степень окисления - 2, +4 и +6.
Закономерность изменения активности этих элементов такая же, как и в подгруппе галогенов: легче всего окисляются теллуриды, затем селениды и сульфиды. Из кислородных соединений серы наиболее устойчивы соединения серы (VI), а для теллура - соединения теллура (IV). Соединения селена занимают промежуточное положение.
В элементах подгруппы хрома идет заполнение d-уровня, поэтому на s-уровне их атомов - по 1 (у хрома и молибдена) или 2 (у вольфрама) электрона. Все они проявляют максимальную степень окисления +6, но для молибдена, и особенно для хрома, характерны соединения, в которых они имеют более низкую степень окисления (+4 для молибдена и +3 или +2 для хрома). Соединения хрома (III) очень устойчивы и похожи на соединения алюминия.
Все металлы подгруппы хрома находят широкое применение.
Молибден был впервые получен К. В. Шееле в 1778 г. Он используется в производстве сталей высокой прочности и вязкости, применяющихся для изготовления оружейных стволов, брони, валов и др.
Из-за способности испаряться при высокой температуре он мало пригоден для изготовления нитей накала, но обладает хорошей способностью сплавляться со стеклом, поэтому используется для изготовления держателей вольфрамовых нитей в лампах накаливания.
Вольфрам был открыт также К. В. Шееле в 1781 г. Он применяется для получения специальных сталей. Добавка вольфрама к стали увеличивает ее твердость, эластичность и прочность. Вместе с хромом вольфрам придает стали свойство сохранять твердость при очень высоких температурах, поэтому такие стали применяются для изготовления резцов к быстрорежущим токарным станкам.
Чистый вольфрам обладает наивысшей среди металлов температурой плавления (3370 град. С), поэтому применяется для изготовления нитей в лампах накаливания. Карбид вольфрама отличается очень большой твердостью и термостойкостью и является основной составной частью тугоплавких сплавов.
Подгруппу азота составляют пять элементов: азот, фосфор, мышьяк, сурьма и висмут. Это р-элементы V группы периодической системы Д. И. Менделеева .На наружном энергетическом уровне атомы этих элементов содержат пять электронов, которые имеют конфигурацию ns2np3 и распределены следующим образом:
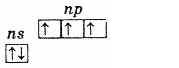
Поэтому высшая степень окисления этих элементов +5, низшая -3, характерна и +3.Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.
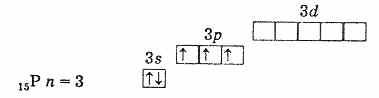
внешняя электронная оболочка фосфора (невозбужденный атом)
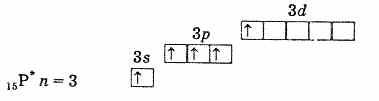
внешняя электронная оболочка возбужденного атома фосфораТаким образом, фосфор, мышьяк, сурьма и висмут в возбужденном состоянии имеют 5 неспаренных электронов, и валентность их в этом состоянии равна 5.В атоме азота возбудить электрон подобным образом нельзя вследствие отсутствия d-подуровня на втором уровне. Следовательно, пятивалентным азот быть не может, однако он может образовать четвертую ковалентную связь по донорно-акцепторному механизму за счет неподеленной электронной пары 2s2. Для атома азота возможен и другой процесс. При отрыве одного из двух 2s-электронов азот переходит в однозарядный четырехвалентный ион N+.

От азота к висмуту радиусы атомов увеличиваются, а ионизационные потенциалы уменьшаются. Восстановительные свойства нейтральных атомов усиливаются от N к Bi, а окислительные ослабевают (см. табл. 21).
С водородом азот, фосфор и мышьяк образуют полярные соединения RH3, проявляя отрицательную степень окисления -3. Молекулы RH3 имеют пирамидальную форму. В этих соединениях связи элементов с водородом более прочные, чем в соответствующих соединениях элементов подгруппы кислорода и особенно подгруппы галогенов. Поэтому водородные соединения элементов подгруппы азота в водных растворах не образуют ионов водорода.
С кислородом элементы подгруппы азота образуют оксиды общей формулы R2O3 и R2O5. Оксидам соответствуют кислоты HRO2 и HRO3 (и ортокислоты H3RO4, кроме азота). В пределах подгруппы характер оксидов изменяется так: N2O3 кислотный оксид; Р4О6 слабокислотный оксид; As2O3 амфотерный оксид с преобладанием кислотных свойств; Sb2O3 амфотерный оксид с преобладанием основных свойств; Bi2O3 основной оксид. Таким образом, кислотные свойства оксидов состава R2O3 и R2O5 уменьшаются с ростом порядкового номера элемента.Как видно из табл. 21, внутри подгруппы от азота к висмуту убывают неметаллические свойства и возрастают металлические. У сурьмы эти свойства выражены одинаково, у висмута преобладают металлические, у азота неметаллические свойства. Фосфор, мышьяк и сурьма образуют несколько аллотропных соединения.
Шестая группа периодической системы элементов состоит из двух подгрупп: главной кислород, сера, селен, теллур и полоний и побочной хром, молибден и вольфрам. В главной подгруппе выделяют подгруппу селена (селен, теллур и полоний), побочную подгруппу называют подгруппой хрома. Все элементы главной подгруппы, кроме кислорода, могут присоединять по два электрона, образуя электроотрицательные ионы.
Элементы главной подгруппы имеют на внешнем электронном уровне по шесть электронов (s2р4). Атомы кислорода имеют два неспаренных электрона и не имеют d-уровня. Поэтому кислород проявляет в основном степень окисления (2 и только в соединениях со фтором +2. Сера, селен, теллур и полоний тоже имеют на внешнем уровне шесть электронов (s2p4), но у всех у них есть незаполненный d-уровень, поэтому они могут иметь до шести неспаренных электронов и в соединениях проявлять степень окисления 2, +4 и +6.
Закономерность изменения активности этих элементов такая же, как и в подгруппе галогенов: легче всего окисляются теллуриды, затем селениды и сульфиды. Из кислородных соединений серы наиболее устойчивы соединения серы (VI), а для теллура соединения теллура (IV). Соединения селена занимают промежуточное положение.
Селен и теллур, а также их соединения с некоторыми металлами (индием, таллием и др.) обладают полупроводниковыми свойствами и широко используются в радиоэлектронике. Соединения селена и теллура очень токсичны. Они применяются в стекольной промышленности для получения цветных (красных и коричневых) стекол.
В элементах подгруппы хрома идет заполнение d-уровня, поэтому на s-уровне их атомов по одному (у хрома и молибдена) или два (у вольфрама) электрона. Все, они проявляют максимальную степень окисления +6, но для молибдена, и особенно для хрома, характерны соединения, в которых они имеют более низкую степень окисления (+4 для молибдена и +3 или +2 для хрома). Соединения хрома (III) очень устойчивы и похожи на соединения алюминия. Все металлы подгруппы хрома находят широкое применение.
Молибден был впервые получен К. В. Шееле в 1778 г. Он используется в производстве сталей высокой прочности и вязкости, применяющихся для изготовления оружейных стволов, брони, валов и др. Из-за способности испаряться при высокой температуре он мало пригоден для изготовления нитей накала, но обладает хорошей способностью сплавляться со стеклом, поэтому используется для изготовления держателей вольфрамовых нитей в лампах накаливания.
Вольфрам был открыт также К. В. Шееле в 178! г. Он применяется для получения специальных сталей. Добавка вольфрама к стали увеличивает ее твердость, эластичность и прочность. Вместе с хромом вольфрам придает стали свойство сохранять твердость при очень высоких температурах, поэтому такие стали применяются для изготовления резцов к быстрорежущим токарным станкам. Чистый вольфрам обладает наивысшей среди металлов температурой плавления (3370 (С), поэтому применяется для изготовления нитей в лампах накаливания. Карбид вольфрама отличается очень большой твердостью и термостойкостью и является основной составной частью тугоплавких сплавов.
Элементы, входящие в VII группу периодической системы, делятся на 2 подгруппы: главную - подгруппу галогенов - и побочную - подгруппу марганца . В эту же группу помещают и водород, хотя его атом имеет на внешнем валентном, уровне единственный электрон и его следовало бы поместить в I группу.
Однако водород имеет очень мало общего как с элементами основой подгруппы - щелочными металлами, так и с элементами побочной подгруппы - медью, серебром и золотом. В то же время он, как и галогены, присоединяя в реакциях с активными металлами электрон, образует гидриды, имеющие некоторое сходство с галогенидами.
К подгруппе галогенов относятся фтор, хлор, бром, иод и астат. Первые 4 элемента встречаются в природе, последний получен искусственно и поэтому изучен значительно меньше остальных галогенов. Слово "галоген" означает солеобразующий. Это название элементы подгруппы получили благодаря легкости, с которой они реагируют со многими металлами, образуя соли.
Все галогены имеют структуру внешней электронной оболочки s 2 p 5 . Поэтому они легко принимают электрон, образуя устойчивую благородногазовую электронную оболочку (s 2 р 6 ). Наименьший радиус атома в подгруппе - у фтора, у остальных он увеличивается в ряду F < Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
Галогены - очень активные элементы. Они могут отнимать электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например фтор вытесняет хлор из хлоридов, бром из бромидов, а иод из иодидов.
Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше 1-го неспаренного электрона и проявляет валентность только -1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода.
К подгруппе марганца принадлежат марганец, технеций и рений. В отличии от галогенов элементы подгруппы марганца имеют на внешнем электронном уровне всего 2 электрона и поэтому не проявляют способности присоединять электроны, образуя отрицательно заряженные ионы.
Марганец распространен в природе и широко используется в промышленности.
Технеций радиоактивен, в природе не встречаемся, а получен искусственно (впервые - Э. Сегре и К. Перрье, 1937 г.) Этот элемент образуется вследствие радиоактивного распада урана. Рений относится к числу рассеянных элементов. Он не образует самостоятельных минералов, а встречается в качестве спутника некоторых минералов, особенно молибденовых.
Он был открыт В. и И. Ноддак в 1925 г. Сплавы, имеющие небольшие добавки рения, обладают повышенной устойчивостью против коррозии. Добавка рения сплавам увеличивает их механическую прочность.
Это свойство рения позволяет применять его вместо благородного металла иридия. Платино-платинорениевые термопары работают лучше платино-платиноиридиевых, но их нельзя использовать при очень высоких температурах, так как образуется летучее соединение Re 2 O 7 .
Главную подгруппу восьмой группы периодической системы составляют благородные газы гелий, неон, аргон, криптон, ксенон и радон . Эти элементы характеризуются очень низкой химической активностью, что и дало основание назвать их благородными, или и н е р т -н ы м и, газами. Они лишь с трудом образуют соединения с другими элементами или веществами; химические соединения гелия, неона и аргона не получены. Атомы благородных газов не соединены в молекулы, иначе говоря, их молекулы одноатомны.
Благородные газы заканчивают собой каждый период системы элементов. Кроме гелия, все они имеют в наружном электронном слое атома восемь электронов, образующих очень устойчивую систему. Также устойчива и электронная оболочка гелия, состоящая из двух электронов. Поэтому атомы благородных газов характеризуются высокими значениями энергии ионизации и, как правило, отрицательными значениями энергии сродства к электрону.
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов например, гидраты
Аг-6Н 2 0, Кг-6Н 2 0, Хе-6Н 2 0, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов валентные связи при образовании подобных соединений не возникают. Образованию клатратов с водой благоприятствует наличие в кристаллической структуре льда многочисленных полостей.
Однако в течение последних десятилетий было установлено, что криптон, ксенон и радон способны вступать в соединение с другими элементами и прежде всего с фтором. Так, ; прямым взаимодействием благородных газов с фтором (при нагревании или в электрическом разряде) получены фториды KrF 2 , XeF 2 , KrF 4 , XeF 4 и RnF 4 . Все они представляют собой кристаллы, устойчивые при обычных условиях. Получены также производные ксенона в степени окисленности;+6 гексафторид XeF 6 , триоксид ХеОз, гидроксид Хе(ОН)б. Последние два соединения проявляют кислотные свойства; так, реагируя со щелочами, они образуют соли ксеноно-вой кислоты, например: Хе0 3 + Ва(ОН) 2 ВаХе0 4 + Н 2 0.
Производные; ксенона (VI)сильные окислители. Однако при действии на них еще более сильных окислителей можно получить соединения, в которых ксенон имеет степень окисленности -4-8. Из подобных соединений известны октафторид XeF 8 , тетраоксид Хе0 4 и оксогексафторид XeOF 6.
Более высокая химическая активность криптона, ксенона и радона по сравнению с первыми членами группы благородных;газов объясняется относительно низкими потенциалами ионизации их атомов. Для криптона, ксенона и радона эти величины близки к потенциалам ионизации некоторых других элементов (например, потенциал ионизации атома азота равен 14,53 В, атома хлора 12,97 В).
Наибольшее практическое применение находят аргон, неон и гелий.
Водород (лат. Hydrogenium), H, химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,0079. При обычных условиях Водород - газ; не имеет цвета, запаха и вкуса.
Историческая справка. В трудах химиков 16 и 17 веков неоднократно упоминалось о выделении горючего газа при действии кислот на металлы. В 1766 году Г. Кавендиш собрал и исследовал выделяющийся газ, назвав его "горючий воздух". Будучи сторонником теории флогистона, Кавендиш полагал, что этот газ и есть чистый флогистон. В 1783 году А. Лавуазье путем анализа и синтеза воды доказал сложность ее состава, а в 1787 определил "горючий воздух" как новый химический элемент (Водород) и дал ему современное название hydrogene (от греч. hydor - вода и gennao - рождаю), что означает "рождающий воду"; этот корень употребляется в названиях соединений Водорода и процессов с его участием (например, гидриды, гидрогенизация). Современное русское наименование "Водород" было предложено М. Ф. Соловьевым в 1824 году.
Распространение Водорода в природе. Водород широко распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. Водород входит в состав самого распространенного вещества на Земле - воды (11,19% Водорода по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (то есть в состав белков, нуклеиновых кислот, жиров, углеводов и других). В свободном состоянии Водород встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуют в атмосфере. В околоземном пространстве Водород в виде потока протонов образует внутренний ("протонный") радиационный пояс Земли. В космосе Водород является самым распространенным элементом. В виде плазмы он составляет около половины массы Солнца и большинства звезд, основную часть газов межзвездной среды и газовых туманностей. Водород присутствует в атмосфере ряда планет и в кометах в виде свободного Н 2 , метана СН 4 , аммиака NH 3 , воды Н 2 О, радикалов типа CH, NH, OH, SiH, PH и т. д. В виде потока протонов Водород входит в состав корпускулярного излучения Солнца и космических лучей.
Изотопы, атом и молекула Водорода. Обыкновенный Водород состоит из смеси 2 устойчивых изотопов: легкого Водорода, или протия (1 H), и тяжелого Водорода, или дейтерия (2 Н, или D). В природных соединениях Водорода на 1 атом 2 Н приходится в среднем 6800 атомов 1 Н. Радиоактивный изотоп с массовым числом 3 называют сверхтяжелым Водородом, или тритием (3 Н, или Т), с мягким β-излучением и периодом полураспада T ½ = 12,262 года. В природе тритий образуется, например, из атмосферного азота под действием нейтронов космических лучей; в атмосфере его ничтожно мало (4·10 -15 % от общего числа атомов Водорода). Получен крайне неустойчивый изотоп 4 Н. Массовые числа изотопов 1 Н, 2 Н, 3 Н и 4 Н, соответственно 1, 2, 3 и 4, указывают на то, что ядро атома протия содержит только один протон, дейтерия - один протон и один нейтрон, трития - один протон и 2 нейтрона, 4 Н - один протон и 3 нейтрона. Большое различие масс изотопов Водорода обусловливает более заметное различие их физических и химических свойств, чем в случае изотопов других элементов.
Атом Водорода имеет наиболее простое строение среди атомов всех других элементов: он состоит из ядра и одного электрона. Энергия связи электрона с ядром (потенциал ионизации) составляет 13,595 эв. Нейтральный атом Водород может присоединять и второй электрон, образуя отрицательный ион Н - при этом энергия связи второго электрона с нейтральным атомом (сродство к электрону) составляет 0,78 эв. Квантовая механика позволяет рассчитать все возможные энергетические уровни атома Водород, а следовательно, дать полную интерпретацию его атомного спектра. Атом Водорода используется как модельный в квантовомеханических расчетах энергетических уровней других, более сложных атомов.
Молекула Водород Н 2 состоит из двух атомов, соединенных ковалентной химической связью. Энергия диссоциации (то есть распада на атомы) составляет 4,776 эв. Межатомное расстояние при равновесном положении ядер равно 0,7414Å. При высоких температурах молекулярный Водород диссоциирует на атомы (степень диссоциации при 2000°С 0,0013, при 5000°С 0,95). Атомарный Водород образуется также в различных химических реакциях (например, действием Zn на соляную кислоту). Однако существование Водорода в атомарном состоянии длится лишь короткое время, атомы рекомбинируют в молекулы Н 2 .
Физические свойства Водорода. Водород - легчайшее из всех известных веществ (в 14,4 раза легче воздуха), плотность 0,0899 г/л при 0°С и 1 атм. Водород кипит (сжижается) и плавится (затвердевает) соответственно при -252,8°С и -259,1°С (только гелий имеет более низкие температуры плавления и кипения). Критическая температура Водорода очень низка (-240°С), поэтому его сжижение сопряжено с большими трудностями; критическое давление 12,8 кгс/см 2 (12,8 атм), критическая плотность 0,0312 г/см 3 . Из всех газов Водород обладает наибольшей теплопроводностью, равной при 0°С и 1 атм 0,174 вт/(м·К), то есть 4,16·10 -4 кал/(с·см·°С). Удельная теплоемкость Водорода при 0°С и 1 атм С p 14,208 кДж/(кг·К), то есть 3,394 кал/(г·°С). Водород мало растворим в воде (0,0182 мл/г при 20°С и 1 атм), но хорошо - во многих металлах (Ni, Pt, Pa и других), особенно в палладии (850 объемов на 1 объем Pd). С растворимостью Водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия Водорода с углеродом (так называемая декарбонизация). Жидкий Водород очень легок (плотность при -253°С 0,0708 г/см 3 ) и текуч (вязкость при -253°С 13,8 спуаз).
Химические свойства Водорода. В большинстве соединений Водород проявляет валентность (точнее, степень окисления) +1, подобно натрию и другим щелочным металлам; обычно он и рассматривается как аналог этих металлов, возглавляющий I группу системы Менделеева. Однако в гидридах металлов ион Водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na + H - построен подобно хлориду Na + Cl - . Этот и некоторые других факты (близость физических свойств Водорода и галогенов, способность галогенов замещать Водород в органических соединениях) дают основание относить Водород также и к VII группе периодической системы. При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами. Атомарный Водород обладает повышенной химические активностью по сравнению с молекулярным. С кислородом Водород образует воду:
Н 2 + 1 / 2 О 2 = Н 2 О
с выделением 285,937 кДж/моль, то есть 68,3174 ккал/моль тепла (при 25°С и 1 атм). При обычных температурах реакция протекает крайне медленно, выше 550°С - со взрывом. Пределы взрывоопасности водородо-кислородной смеси составляют (по объему) от 4 до 94% Н 2 , а водородо-воздушной смеси - от 4 до 74% Н 2 (смесь 2 объемов Н 2 и 1 объема О 2 называется гремучим газом). Водород используется для восстановления многих металлов, так как отнимает кислород у их оксидов:
CuO + H 2 = Cu + H 2 O,
Fe 3 O 4 + 4H 2 = 3Fe + 4Н 2 О, и т. д.
С галогенами Водород образует галогеноводороды, например:
Н 2 + Cl 2 = 2НСl.
При этом с фтором Водород взрывается (даже в темноте и при - 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а с иодом только при нагревании. С азотом Водород взаимодействует с образованием аммиака:
ЗН 2 + N 2 = 2NН 3
лишь на катализаторе и при повышенных температуpax и давлениях. При нагревании Водород энергично реагирует с серой:
Н 2 + S = H 2 S (сероводород),
значительно труднее с селеном и теллуром. С чистым углеродом Водород может реагировать без катализатора только при высоких температуpax:
2Н 2 + С (аморфный) = СН 4 (метан).
Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя гидриды:
Н 2 + 2Li = 2LiH.
Важное практическое значение имеют реакции Водорода с оксидом углерода (II), при которых образуются в зависимости от температуры, давления и катализатора различные органические соединения, например НСНО, СН 3 ОН и другие. Ненасыщенные углеводороды реагируют с Водородом, переходя в насыщенные, например:
С n Н 2n + Н 2 = С n Н 2n+2 .
Роль Водород и его соединений в химии исключительно велика. Водород обусловливает кислотные свойства так называемых протонных кислот. Водород склонен образовывать с некоторыми элементами так называемую водородную связь, оказывающую определяющее влияние на свойства многих органических и неорганических соединений.
Получение Водорода. Основные виды сырья для промышленного получения Водорода - газы природные горючие, коксовый газ и газы нефтепереработки. Водород получают также из воды электролизом (в местах с дешевой электроэнергией). Важнейшими способами производства Водорода из природного газа являются каталитическое взаимодействие углеводородов, главным образом метана, с водяным паром (конверсия):
СН 4 + H 2 О = СО + ЗН 2 ,
и неполное окисление углеводородов кислородом:
СН 4 + 1 / 2 О 2 = СО + 2Н 2
Образующийся оксид углерода (II) также подвергается конверсии:
СО + Н 2 О = СО 2 + Н 2 .
Водород, добываемый из природного газа, самый дешевый.
Из коксового газа и газов нефтепереработки Водород выделяют путем удаления остальных компонентов газовой смеси, сжижаемых более легко, чем Водород, при глубоком охлаждении. Электролиз воды ведут постоянным током, пропуская его через раствор КОН или NaOH (кислоты не используются во избежание коррозии стальной аппаратуры). В лабораториях Водород получают электролизом воды, а также по реакции между цинком и соляной кислотой. Однако чаще используют готовый заводской Водород в баллонах.
Применение Водорода. В промышленном масштабе Водород стали получать в конце 18 века для наполнения воздушных шаров. В настоящее время Водород широко применяют в химической промышленности, главным образом для производства аммиака. Крупным потребителем Водорода является также производство метилового и других спиртов, синтетического бензина и других продуктов, получаемых синтезом из Водорода и оксида углерода (II). Водород применяют для гидрогенизации твердого и тяжелого жидкого топлив, жиров и других, для синтеза HCl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке (до 4000°С). Очень важное применение в атомной энергетике нашли изотопы Водорода - дейтерий и тритий.
Химические свойства элементовСтраница 13
Химия - наука, изучающая химические элементы, образуемые ими простые и сложные вещества (состав, строение, свойства), их превращения и законы, которым эти превращения подчиняются. Подразделяется на неорганическую, органическую, физическую, аналитическую, коллоидную и др. Современная химия связана с другими науками, в результате чего возникают пограничные области науки: биохимия, агрохимия, космохимия, радиохимия и др. Достижения современной химии являются стимулом интенсивного роста химической промышленности, играют важную роль в научно-техническом прогрессе всех отраслей народного хозяйства. Химия играет важную роль в решении наиболее актуальных и перспективных проблем современного общества (увеличение эффективности и безопасности искусственных удобрений для повышения урожайности сельскохозяйственной продукции и проблема синтеза продуктов питания из непродовольственного сырья; освоение океанических источников сырья; разработка и создание новых источников энергии; синтез новых веществ и композиций, необходимых для решения задач в будущем; охрана окружающей среды). См №2, с334.
Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют совокупность атомов с одинаковым зарядом ядер. В свою очередь, атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Таким образом, каждому химическому элементу соответствует определённый вид атомов. См. №3, с11.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов. Молекулы могут быть одно-, двух- и многоатомными. Они являются составными частицами вещества. Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например He, Ar, H2, O2, O3, S4, P4. Простое вещество является формой существования химического элемента в свободном состоянии. См. №3, с11 с12.
Если молекула вещества состоит из разных атомов, то вещество называют сложным (или химическим соединением), например CO, H2O, NH3, H3PO4. Любое вещество характеризуется определённым составом (природой и числом атомов в его молекуле), строением (пространственным расположением атомов в молекуле) и определёнными физическими и химическими свойствами. См. №3, с12.
Химические свойства вещества характеризуют его способность участвовать в химических реакциях, то есть в процессах превращения одних веществ в другие. Для понимания этих свойств необходимо знать состав и строение веществ. См. №3, с12.
Всю таблицу Менделеева можно разделить на металлы, неметаллы и амфотерные вещества. Металлы - простые вещества, характеризующиеся способностью отдавать электроны, расположенные на внешнем энергетическом уровне (валентные электроны) и переходить в положительно заряженные ионы. Практически все металлы обладают высокой электро- и теплопроводностью, способностью хорошо отражать световые волны (чем и обуславливается их блеск и непрозрачность), пластичностью. В твёрдом состоянии обычно имеют кристаллическое строение. Связь между атомами в металле осуществляется валентными электронами, которые свободно перемещаются в кристаллической решётке, образуемой положительно заряженными ионами металла. Из 107 элементов периодической системы, 83 элемента являются металлами. Многие эксплуатационные свойства металлов зависят не только от их химических свойств, но и от структуры, которую они приобретают в результате способов получения и последующей обработки. Это создаёт возможности широкого изменения свойств металлов и делает их важнейшими конструкционными, электротехническими, механическими и другими материалами. На сегодняшний день, металлы находят широкое применение в различных областях техники. Неметаллы - простые вещества, не обладающие ковкостью, металлическим блеском, являются плохими проводниками тепла и электричества. Для атомов неметаллов преимущественно характерна способность присоединять электроны, т.е. превращаться в отрицательно заряженные ионы. К неметаллам относятся 22 элемента: H, B, C, Si, N, P, As, O, S, Se, Te, галогены и благородные газы. Оксиды неметаллов носят кислотный характер, им соответствуют кислородсодержащие кислоты. Амфотерные вещества - вещества, которым свойственно проявлять как кислотные, так и основные свойства. Амфотерное вещество, реагируя, например, с сильным основанием, может проявить кислотные свойства, в то же время, это же вещество, реагируя с сильной кислотой, может проявить основные свойства. См №2, с273, с279, с225.
Рассмотрим периодическую систему химических элементов. Она создана на основании периодического закона. Таблица состоит из 7 периодов и 8 групп.
Периоды горизонтальные ряды таблицы, они подразделяются на большие и малые. В мылах периодах находится 2 элемента (1-й период), либо 8 элементов (2-й и 3-й периоды), в больших периодах 18 элементов (4-й и 5-й) или 32 элемента (6-й период). 7-й период пока не закончен. Любой период начинается с типичного металла, а заканчивается типичным неметаллом и благородным газом. См №1, с271.
Вертикальные столбцы называются группами элементов. Каждая группа делится на две подгруппы главную и побочную. Подгруппа совокупность элементов, являющимися химическими аналогами. Часто элементы подгруппы обладают высшей степенью окисления, соответствующей номеру группы. См №1, с271.
В главных подгруппах химические свойства элементов могут меняться в шир
"Химия. 9 класс". О.С. Габриелян (гдз)
Характеристика химических элементов. Периодический закон Менделеева
Вопрос 1.
Периодический закон Менделеева - один из основополагающих законов химии. Можно утверждать, что вся современная химия построена на нем. Он объясняет зависимость свойств атомов от их строения, обобщает эту зависимость для всех элементов, разделяя их на различные группы, а также предсказывает их свойства в зависимости от строения и строение в зависимости от свойств.
Существуют другие законы, несущие объясняющую, обобщающую и предсказательную функции. Например, закон сохранения энергии, закон преломления света, генетический закон Менделя, закон всемирного тяготения и др.
Вопрос 2.
Руководствуясь периодической системой, найдем элемент с нужным расположением электронов на энергетических уровнях (2 и 5). Этот элемент - азот: N: 1s 2 2s 2 2p 3 .
Данный элемент образует простое вещество - N 2 , азот. Водородное соединение азота- NH 3 , аммиак. Высший оксид азота - N 2 O 5 . Этот оксид относится к кислотным оксидам, потому что при растворении в воде переходит в сильную азотную кислоту HNO3.
N 2 O 5 + H 2 O = 2HNO 3 ;
N 2 O 5 + BaO = Ba(OH) 2 ;
N 2 O 5 + Ba(OH) 2 = Ba(NO 3) 2 + H 2 O;
Азот в степени окисления +5(N +5) обладает сильными окислительными свойствами:
2N 2 O 5 + 5C = 2N 2 + 5CO 2 .
Вопрос 3.
Раньше элемент бериллий ошибочно относили к III группе. Причина этого заключалась в неправильном определении атомной массы бериллия (вместо 9 ее считали равной 13,5). Д.И. Менделеев предположил, что бериллий находится в ІІ группе, основываясь на химических свойствах элемента. Свойства бериллия были очень похожи на свойства магния (Mg) и кальция (Са), и совершенно не похожи на свойства алюминия (Al). Зная, что атомные массы Li и B, соседних элементов к Be, равны соответственно 7 и 11, Д.И.Менделеев предположил, что атомная масса бериллия равна 9.
Вопрос 4.
Са - атом, у которого электроны распределены согласно ряду
чисел 2, 8, 8, 2.
Элемент №7-N,
элемент №8 - О.
Уравнения реакций:
3Ca + N 2 = Ca 3 N 2 ,
2Ca + O 2 = 2CaO.
Продукты реакций имеют ионный тип связи.
Азот и кислород имеют молекулярное строение кристаллических решеток, а у кальция металлическая кристаллическая решетка.
Продукты взаимодействия - Ca 3 N 2 и СаО имеют ионное строение кристаллической решетки.
Вопрос 5.
N, P, As, Sb, Bi – усиление металлических свойств.
Металлические свойства в группах усиливаются.
Вопрос 6.
В ряду элементов: N, Mg, Al, Si, P, S, Cl - усиление неметаллических свойств.
Неметаллические свойства элементов в периодах усиливаются.
Вопрос 7.
Cl 2 O 7 , P 2 O 5 , SiO 2 , Al 2 O 3 , MgO, Na 2 O – уменьшение кислотных свойств.
Кислотные свойства в периодах увеличиваются.
HClO 4 , H3PO 4 , H 2 SO 4 , Al(OH) 3 , NaOH – уменьшение кислотных свойств.
Вопрос 8.
B 2 O 3 , BeO, Li 2 O – возрастание основных свойств.
B(OH) 3 , Be(OH) 2 , LiOH - возрастание основных свойств.
B(OH) 3 – слабая кислота;
Be(OH) 2 - слабое основание;
LiOH – сильное основание.
Вопрос 9.
Периодическая система элементов отражает взаимосвязь химических элементов. Атомный номер элемента равен заряду ядра, численно он равен числу протонов. Число нейтронов, содержащихся в ядрах одного элемента, в отличие от числа протонов, может быть различным. Атомы одного элемента, ядра которых содержат разное число нейтронов, называются изотопами.
Каждый химический элемент имеет по нескольку изотопов (природных или полученных искусственно). Атомная масса химического элемента равна среднему значению из масс всех его природных изотопов с учетом их распространенности.
С открытием изотопов для распределения элементов по периодической системе стали использовать заряды ядер, а не их атомные массы.
Вопрос 10.
Так происходит из-за того, что свойства элементов и их соединений зависят не от общего числа электронов, а только от числа валентных, которые находятся на последнем слое. Количество валентных электронов меняется периодически, следовательно, свойства элементов также меняются периодически.
Вопрос 11.
1. Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
2. Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от заряда атомных ядер элементов.














