Алюминий был открыт в 1825 году датским физиком Х.К. Эрстедом.
Ребята, опишите местоположение данного металла в Переодической системе Менделеева :
Обучаемые: Алюминий – элемент третьего периода и IIIА подгруппы, порядковый номер 13.
Учитель: Давайте разберемся со строением атома:
Заряд ядра атома: +13.
Количество протонов и электронов в неионизированном атоме всегда одинаково и равно порядковому номеру в периодической таблице Менделеева, для алюминия Al - 13, а теперь найдем значение атомной массы (26,98) и округлим его, получим 27. Скорее всего, что его наиболее распространенный изотоп будет иметь массу равную 27. Следовательно, в ядре этого изотопа будет находиться 14 нейтронов (27–13=14). Количество нейтронов в неионизированном атоме Al = 14., т.о. p13n14e13
Электронную формула атома алюминия:
13 А l 1 S 2 2 S 2 2 P 6 3 S 2 3 P 1
графическая формула:
1s 2 2s 2 2p 6 3s 2 3p 1
Учитель: Из приведенной вами формулы мы видим, что атом алюминия имеет одни промежуточный 8-и электронный слой, который препятствует притяжению внешних электронов к ядру. Поэтому, у атома алюминия восстановительные свойства выражены гораздо сильнее, чем у атома бора. Почти во всех своих соединениях Аl имеет степень окисления +3.
Метал или неметалл: Является М (Металлическая связь, металлическая решетка со свободно перемещающимися электронами).
Высшая положительная степень окисления: +3 – в соединениях, 0 – в простом веществе.
Формула высшего оксида: Аl 2 O 3 бесцветные нерастворимые в воде кристаллы. Химические свойства - амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей.
Al 2 O 3 +6HCl→2AlCl 3 +3H 2 O
Al 2 O 3 +2 KOH (температура)→2 KAlO 2(алюминат калия) + H 2 О
Формула высшего гидроксида: Al(OH) 3 – амфотерный гидроксид (проявление основных и кислотных свойств).
Упрощенное Al ( OH ) 3 +3 KOH = KAlO 2 +3 H 2 O
Реальный процесс отражается таким уравнением: Al ( OH ) 3 + KOH = K [ Al ( O Н) 4 ]
Al(OH) 3 +3HCl=AlCl 3 +3H 2 O
Валентность по водороду : отсутствует
Формула летучего водородного соединения : отсутствует
Сравнение Al с соседними по периоду, подгруппе, группе, радиусу, электроотрицательности, энергии ионизации .
B Радиус атома(увел.)
Al Энергия ионизации (уменьш.)
Ga Электроотрицательность (уменьш.)
М свойства (увел.)
Радиус атома(увел.)
Энергия ионизации (уменьш.)
Электроотрицательность (уменьш.)
М свойства (увел.)
Тема урока: «Химические свойства алюминия и его соединения».
Тип урока: комбинированный
Задачи:
Образовательные:
1. Показать зависимость физических свойств алюминия от наличия в нем металлической связи и особенностей кристаллического строения.
2. Сформировать у учащихся знания о том, что алюминию в свободном состоянии присущи особые, характерные физические и химические свойства.
Развивающие:
1. Возбудить интерес к изучению науки путем предоставления кратких исторических и научных сообщений о прошлом, настоящем и будущем алюминия.
2. Продолжить формирование исследовательских навыков учащихся при работе с литературой, выполнением лабораторной работы.
3. Расширить понятие амфотерности раскрытием электронного строения алюминия, химических свойств его соединений.
Воспитательные:
1. Воспитывать бережное отношение к окружающей среде, предоставляя сведения о возможном использовании алюминия вчера, сегодня, завтра.
2. Формировать умения работать коллективом у каждого учащегося, считаться с мнением всей группы и отстаивать свое корректно, выполняя лабораторную работу.
3. Знакомить учащихся с научной этикой, честностью и порядочностью естествоиспытателей прошлого, предоставляя сведения о борьбе за право быть первооткрывателем алюминия.
Характеристика простого вещества:
Алюминий является металлом, таким образом, (металлическая связь; металлическая решетка, в узлах которой расположены свободно перемещающиеся общие электроны ).
Введение 3
1. Физические и химические свойства алюминия 5
2. Получение алюминия 9
3. Алюминий в природе 10
4. Применение алюминия и его сплавов 12
Заключение 16
Список использованной литературы 18
Введение
Впервые общественность познакомилась с алюминием на Всемирной парижской выставке 1855 года, где были представлены небольшие слитки нового металла. Публика была разочарована. В газетах писали: «Парижской выставке суждено было положить конец сказке о серебре из глины. Алюминий был там показан публично, и при этом стало ясно, что большую часть того, что о нем говорилось, следует приписать фантазии и легковерности широкой публики. Вместо ожидаемых гор алюминия там оказалось всего 12 маленьких брусочков, общим весом, пожалуй, около килограмма, что, конечно, не много для открытия, которое казалось способным перевернуть мир». Однако постепенно из редкой диковинки, некогда ценившейся наравне с драгоценными металлами, алюминий превратился в незаменимый материал архитекторов, конструкторов и дизайнеров. Так, в 1967 году американский дизайнер Оскар де ла Рента произвел сенсацию в мире моды, представив публике купальник из тончайшей алюминиевой нити.
Этот металл с поразительно разнообразными свойствами всего за два века с момента своего появления сумел завоевать мир, став синонимом технического прогресса. А XXI век, по всеобщему признанию, и вовсе обещает стать веком алюминия.
Сегодня алюминий дороже простой углеродистой стали, но дешевле нержавеющей. Если рассчитывать стоимость алюминиевых и стальных изделий с учетом их массы и относительной устойчивости к коррозии, то оказывается, что в наши дни во многих случаях значительно выгоднее применять алюминий, чем сталь.
Алюминий - металл третьего тысячелетия. Долговечный, высокопрочный и легкий, устойчивый к коррозии, деформации и воздействиям внешней среды, эстетичный и простой в обслуживании алюминий является одним из самых востребованных металлов в современной промышленности.
1. Физические и химические свойства алюминия
В периодической системе Д. И. Менделеева из 110 элементов 87 являются металлами. Они находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп. Однако многие металлы обладают амфотерными свойствами и иногда могут вести себя как неметаллы.
Алюминий - элемент III периода главной подгруппы III группы.
Обозначается символом Al (лат. Aluminium).
Работа опубликована
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
3 Al 2e - , 8e - , 3e -
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s 2 -электронов и один электрон переходит 3p-орбиталь:
В результате получаются три неспаренных электрона. Ответьте на вопрос 1 (с. 138 ).
> Нахождение алюминия в природе, его получение и свойства
Алюминий -- третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.
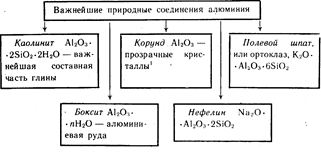
Окрашенные кристаллы Al 2 O 3 красного цвета -- рубины, синего цвета - сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl 3 +3K 3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Физические свойства
Алюминий -- серебристо-белый металл, легкий (= 2,7 г/cм 3), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).
Химические свойства
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl 2 2А1С1 3 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью -- амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН 2А1(ОН)3 + 3Н2
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:

Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины -- сплавы алюминия с кремнием. Основные преимущества этих сплавов--легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе 3 O 4 с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
8Al + 3Fe 3 O 4 4Al 2 O 3 + 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2--6 (с. 138). Решите задачи 1 - 2 (с. 138).
Страница 1
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
3Al 2e-, 8e-, 3e-
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s2-электронов и один электрон переходит 3p-орбиталь:
В результате получаются три неспаренных электрона. Ответьте на вопрос 1 .
Нахождение алюминия в природе, его получение и свойства
Алюминий - третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.

Окрашенные кристаллы Al2O3 красного цвета - рубины, синего цвета – сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl3 +3K 3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Физические свойства
Алюминий - серебристо-белый металл, легкий (r = 2,7 г/cм3), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).
Химические свойства
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl2 ® 2А1С13 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью - амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН ® 2А1(ОН)3¯ + 3Н2
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:

Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины - сплавы алюминия с кремнием. Основные преимущества этих сплавов-легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе3O4 с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2-6 (с. 138). Решите задачи 1 – 2 (с. 138).
Важнейшие соединения алюминия
Оксид алюминия
Аl2О3 можно получить следующими способами:
1. Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
4Al + 3O2 ® 2А12O3
2. Путем превращения по приведенной ниже схеме:
Оксид алюминия - твердое, тугоплавкое (темп. пл. 2050 °С) вещество белого цвета.
По химическим свойствам это амфотерный оксид (I, § 37). Реагирует с кислотами, проявляет свойства основных оксидов:
А12O3 + 6НС1 2А1С13 + 3Н2O
Al2O3 + 6H+ +6С1- 2Al3+ + 6С1- + 3Н2O
Актуально о образовании:
Элементы III-А группы периодической системы
Алюминий Al (лат. Aluminium, от лат. alumen - квасцы). Аl- элемент III группы 3-го периода периодической системы Д. И. Менделеева, п. н. 13, атомная масса 26,9815, имеет один стабильный изотоп 27Al (100 %). Металлический Аl был получен в 1827г. Вёлером. По содержанию в земной коре (8,8 %) Аl занима...
Уровневая дифференциация обучения на основе обязательных результатов
В данной технологии предлагается введение двух стандартов: для обучения (уровень, который должна обеспечить школа интересующемуся, способному и трудолюбивому выпускнику) и стандарта обязательной общеобразовательной подготовки (уровень, которого должен достичь каждый). Пространство между уровнями об...
Система инженерного образования в США
Вообще, в США принята многоступенчатая система высшего образования, в соответствии с которой обучение делится на несколько циклов. Первый - undergraduate - продолжается четыре года и завершается получением степени бакалавра. Так как первые два года студенты изучают общеобразовательные дисциплины, о...
Цель урока: создать условия для исследования учащимися физических и химических свойств алюминия на основе строения его атома.
Задачи урока:
1. Рассмотреть алюминий как химический элемент и простое вещество; закрепить знания о строении металлов, их общих физических и химических свойствах, умения записывать уравнения химических реакций, читать их, определять тип, рассматривать в свете представлений о процессах окисления и восстановления.
2. Развивать мыслительные операции анализа, синтеза, сравнения, а также логику, внимание и наблюдательность.
3. Формировать научное мировоззрение, умения подходить к решению бытовых вопросов с научной точки зрения, применять свои знания.
Метод обучения: проблемный.
Организационные формы: беседа, самостоятельная работа, практическая работа.
Средства обучения: маршрутная карта, инструкция, химическое оборудование, таблицы.
Демонстрационное оборудование: таблицы, демонстрационный штатив, алюминиевая проволока, железный гвоздь, пробирки с водой, спиртовка, спички, пластилин, источник тока, ключ, лампочка.
Оборудование на столах учащихся: алюминий, раствор гидроксида натрия, соляная кислота, штатив для пробирок, две пробирки с водой, в которых находятся алюминиевая проволока и железный гвоздь, спиртовка, спички, держатель для пробирок.
Ход урока
I. Ориентировочно-мотивационный этап (мотивация, актуализация знаний).
1. Вступительное слово учителя. Приветствие.
– Ребята, я сейчас прочитаю вам стихотворение, а вы внимательно его прослушайте и назовите, о каком химическом элементе идет речь.
Спрятан в ящике предмет –
Без него не съесть обед.
Вещь незаменимая.
Вещь необходимая.
Если мы садимся кушать,
Тот предмет нам очень нужен.
Из чего же сей предмет?
Серебристо-белый цвет
Вам позволит дать ответ.
– О каком же предмете идет речь? (Правильно, об алюминиевой ложке .)
– Итак, ребята, тема урока “Алюминий: химический элемент и простое вещество”.
– Как вы думаете, а что можно узнать на уроке об алюминии?
2. Проверка домашнего задания.
Но прежде, чем приступить к изучению нового материала, давайте вспомним, что вы изучили на предыдущем уроке. А для этого ответьте мне, пожалуйста, на следующие вопросы (за правильный ответ звездочки).
1. Рассказать о положении железа в периодической системе Д.И. Менделеева.
2. Записать схему строения атома железа и его электронную конфигурацию.
3. Послушаем небольшие сообщения о соединениях железа.
4. При помощи каких реактивов можно определить в растворе ионы железа Fе 2 + Fе 3 ? (Двухвалентного и трехвалентного .)
– Молодцы ребята! Материал прошлого урока вами усвоен хорошо. В конце урока покажите мне свои звездочки. Перейдем к изучению нового материала. У каждого из нас есть свой адрес: это улица, дом, квартира. У химических элементов тоже есть свой “дом”. Как он называется? Какие “адреса” имеют химические элементы? Сегодня мы познакомимся с одним из “жильцов” этого дома. А для этого мы отправимся в путешествие, чтобы познакомиться с удивительным химическим элементом – алюминием и образованным им простым веществом. Для этого вам понадобится маршрутная карта.
II.
Операционно-исполнительский этап (изучение нового материала)Запишите в маршрутной карте дату нашего путешествия и тему урока.
1) Вы находитесь на станции под названием “Визитка химического элемента” . Задание для каждого индивидуально: найдите алюминий в ПСХЭ и заполните первую часть маршрутной карты. Время выполнения 3 мин., кто первый выполнит правильно задание – звездочка. Давайте проверим ваши записи (пожалуйста, к доске...).
Возникли ли у вас трудности с составлением схемы расположения электронов атома алюминия по атомным орбиталям?
В первой схеме трудностей нет. А что же означает 2-я схема: Аl*. При переходе атома в возбужденное состояние электрон с 3s – подуровня переходит на свободную орбиталь 3р – подуровня. Тогда электронная формула атома алюминия изменяется.
– Какая степень окисления характерна для алюминия? (+3)
– Какими свойствами обладает этот элемент – металлическими или неметаллическими? (Металлическими .)
– Какое простое вещество образует элемент, который обладает металлическими свойствами? (Металл .)
– Значит, алюминий – это металл. Посмотрите на химические элементы, окружающие алюминий в ПСХЭ. Слева от него находятся активные металлы, справа – неметаллы.
– Сделайте вывод об активности алюминия. (Аl – неактивный металл .)
Обратимся к электрохимическому ряду напряжений металлов. Здесь алюминий находится сразу после активных металлов, а за ним стоят тоже достаточно активные металлы.
– Какова же активность алюминия? (Аl – активный металл .)
– У меня на столе находятся два стакана с водой. В воду неделю назад были помещены железный гвоздь и алюминиевая проволока.
– Что же мы наблюдаем? (Железо вступило во взаимодействие с водой, изменил цвет, а с алюминиевой проволокой ничего не произошло .)
– Еще раз посмотрите на электрохимический ряд напряжений металла.
– Какой из металлов – Аl или Fе – более активный? (Получается, что Аl.)
– Почему же алюминиевая проволока не реагирует, а железный гвоздь вступает с ней во взаимодействие?
Итак, активный ли металл алюминий? – вот какую проблему нам предстоит сегодня решить.
Поскольку сведений, полученных на станции “Визитка химического элемента”, недостаточно, чтобы сделать окончательный вывод об активности алюминия, будем двигаться к следующей станции – “Физические свойства простого вещества” .
2) Сейчас вам предстоит работа в парах. Возьмите алюминиевую проволоку, рассмотрите ее, попробуйте изменить ее форму.
И вот незаметно мы подошли ко второй станции нашего маршрута, которая называется “Физические свойства простого вещества”.
Сейчас, ребята, вам предстоит работать в парах с текстом учебника. Откройте учебник на с. 57 и прочтите только один абзац, который начинается со слов “Алюминий – простое вещество”.
На основании текста и вашего жизненного опыта охарактеризуйте физические свойства алюминия и запишите их. В случае затруднения поставьте карандашом знак вопроса напротив соответствующего свойства. (Кто первый выполнит – поднимает руку – за правильный ответ – звездочка.)
Алюминий называют “крылатым” металлом, так как из-за своей легкости, прочности в сплавах и коррозийной стойкости применяют в самолето- и ракетостроении.
Как вы уже сказали, алюминий обладает еще высокой теплопроводностью. Для доказательства теплопроводности алюминия я продемонстрирую опыт. (В лапке демонстрационного штатива закреплю горизонтально алюминиевую проволоку, к которой прикреплю пластилином две спички. Конец проволоки нагрею в пламени спиртовки. Через некоторое время спички по очереди падают.)
– Позволяют ли знания, полученные на этой станции, сделать вывод об активности алюминия? (Нет .)
3) Следующая станция нашего путешествия не менее интересная, чем предыдущая и называется “Химические свойства простого вещества” .
Во время достаточно длительной стоянки на этой станции вы пройдете два этапа. На первом этапе будете исследовать взаимодействие алюминия с простыми веществами, на втором – со сложными.
Итак, первый этап. Составьте три уравнения реакций алюминия с простыми веществами с кислородом, серой и хлором и покажите изменение степени окисления элементов. Заполните таблицу в маршрутной карте.
(Эту реакцию можно наблюдать при горении бенгальских огней и фейерверков – порошок алюминия при сильном нагревании воспламеняется и сгорает ослепительным пламенем.)
– Чем является алюминий в данных реакциях – окислителем или восстановителем? (Активным восстановителем .)
Все эти реакции идут при нагревании.
На втором этапе исследуем взаимодействие алюминия со сложными веществами: соляной кислотой и раствором гидроксида натрия.
Ребята, а взаимодействует ли алюминий с водой? Я вижу, что вы затрудняетесь ответить на этот вопрос.
– Происходит ли химическая реакция, когда вы наливаете воду в алюминиевую посуду? Происходит ли что-либо с алюминиевыми электропроводами, когда идет дождь?
– Перечисленные изделия не изменяются под действием воды, поскольку алюминий покрыт прочной оксидной пленкой. Если эту пленку снять, алюминий будет реагировать с водой (и некоторыми простыми веществами) даже при обычных условиях.
Эту пленку можно снять, то есть разрушить с помощью наждачной бумаги или химическим способом (например, раствором щелочи) или поверхность алюминия потереть солью ртути, то происходит реакция:
2Аl + 3НqСl 2 –> АlСl 3 + 3Hq
Выделившаяся ртуть растворяет алюминий и образует его сплав с ртутью – амальгама алюминия . На амальгированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях:
2Аl + 6НОН –> 2Аl(ОН) 3 + 3Н 2
Алюминий хорошо растворяется в разбавленных НСl и Н 2 SО4 кислотах. А вот концентрированные Н 2 SО 4 и HN0 3 кислоты пассивируют кислоты, образуя на поверхности металла оксидную пленку, то есть препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Опыт I. Взаимодействие алюминия с раствором НСl кислоты.
В пробирку поместить два кусочка алюминия и один мл. раствора кислоты. Если реакция не происходит, содержимое пробирки слегка нагреть.
2Аl + 6НСl = 2АlО 3 + 3Н 2
(2Аl + 3Н 2 SО 4 = Аl 2 (SО 4) 3 + 3Н 2)
Опыт II. Взаимодействие алюминия с раствором щелочи.
В пробирку поместить два кусочка алюминия и один мл. раствора щелочи. Если реакция не происходит – нагреть.
И в I и во II опыте реакции сразу не идут, хотя алюминий – активный металл, так как мешает оксидная пленка, дальше идет бурная реакция, так как пленка разрушена.
(2Аl + 2NaОН + 2Н 2 О = 2NaАlO 2 + 3Н 2) – алюминат натрия
Составьте схемы уравнений реакций.
– Какой можно сделать вывод об активности металла? (Активный металл .)
Алюминий – химически активен, он может реагировать с неметаллами, водой, кислотами.
Ребята, ученые доказали, что:
Алюминий нам судороги вызывает
И память у людей снижает.
Он угнетает ряд ферментов,
Особенно кроветворенья центры,
И слабоумие – его работа!
Почему же тогда из алюминия делают посуду!
Получается, что алюминиевой посудой нельзя пользоваться? Можно, так как на ее поверхности что образуется? Оксидная пленка! Которая предохраняет алюминий от воздействия факторов внешней среды. Только в ней нельзя готовить кислые и щелочные продукты, значит, картофель (который содержит крахмал) можно.
Для того чтобы алюминий начал реагировать, с его поверхности нужно удалить оксидную пленку. Иногда в алюминиевых кастрюлях на дне мы видим черные пятна, произошло разрушение оксидной пленки. Вот такой посудой пользоваться нельзя.
III. Первичная проверка усвоения знаний.
Следующая станция – “Выбери задание” . В течение 4 мин. вам необходимо выполнить одно из трех заданий своего варианта (по выбору). Выбирайте только то задание, с которым вы справитесь. (Смотрите маршрутную карту.)
· Закончите уравнение реакции. Напишите его в полном и сокращенном ионном виде:
Аl + НСl –> ... (вариант I);
Аl + Н 2 SО 4 –> ... (вариант II).
· Напишите уравнения реакций в соответствии со схемой:
Аl –> Аl 2 О 3 –> Аl(NО 3) 3 (вариант I);
Аl –> АlСl 3 –> Аl(NO 3) 3 (вариант II).
· Определите неизвестное вещество и напишите уравнения реакций в соответствии со схемой:
Аl –> ... –> Аl(ОН) 3 (вариант I);
Аl –> ... –> АlСl 3 (вариант II).
IV.
Первичное закрепление знанийВы достигли последней станции. В ваших тетрадях получился опорный конспект урока.
– Если бы мы продолжили путешествие, на каких станциях вам необходимо было еще побывать? (“Нахождение в природе”, “Получение”, “Применение” .)
Алюминий – самый распространенный из металлов в земной коре. На его долю приходится 8,8% от ее массы. Однако промышленный способ его получения был открыт сравнительно недавно. В 1886 г. к профессору Иветту вбежал молодой американский инженер Чарльз Мартин Холл, держа на протянутой ладони 12 маленьких шариков алюминия, впервые полученного электролитическим способом...
Но этот материал вы изучите на следующем уроке.
V.
Подведение итогов занятия. РефлексияВернемся к теме сегодняшнего урока.
– Какую проблему мы поставили в начале его?
– Удалось ли нам ее решить?
– К какому выводу мы пришли?
Приложение
Элементы и атомы
В менделеевский взятые круг,
Сделали химию самой богатой.
И самой творческой из наук.
(Г.Санников)
Маршрутная карта
Цель: изучить положение алюминия в Периодической системе, строение атома элемента, физические и химические свойства простого вещества.
Станция 1. “Визитка химического элемента”
Время стоянки 3 минуты. Работая индивидуально, определите местоположение элемента в периодической системе, составьте электронную формулу атома. Сделайте записи:
алюминий
химический элемент
химический знак: атомная масса Аr(Аl) =
порядковый номер:
период:
группа:
подгруппа-ряд:
строение атома:
электронная конфигурация:
простое вещество
химическая формула:
молекулярная масса Мr(Аl) –
Станция 2. “Физические свойства простого вещества”
Время стоянки 5 минут. Работайте в парах. Запишите в маршрутной карте физические свойства вещества
цвет:
агрегатное состояние:
пластичность:
металлический блеск:
теплопроводность:
электропроводность:
плотность:
температура плавления:
сплавы:
Станция 3. “Химические свойства простого вещества”
Время стоянки 10 минут. Работая в группах по 4 человека, составьте уравнение химической реакции взаимодействия алюминия с веществами. Сделайте выводы. Одно уравнение химической реакции запишите в окислительно-восстановительной форме. Покажите переход электронов.
Взаимодействия алюминия |
|
с простыми веществами |
со сложными веществами Аl –> А1 2 О 3 –> Аl(НО 3) 3 (вариант I); Аl –> АlСl 3 –> Аl(НО 3) 3 (вариант II). Определите неизвестное вещество и напишите уравнения реакций в соответствии со схемой: Аl –> ... –> Аl(ОН) 3 (вариант I); Аl –> ... –> АlСl 3 (вариант II). Спасибо за работу! Ваше домашнее задание. На основе материала учебника и опорного конспекта составьте рассказ по данной теме “Следует ли использовать алюминиевую посуду?”. Приведите аргументы “за” и “против”. |